题目内容
下列各组微粒中,氧化性依次增强,且半径依次减小的是( )
| A、O、Cl、S、P |
| B、K+、Mg2+、Al3+、H+ |
| C、I-、Br-、Cl-、S2- |
| D、Al3+、Mg2+、Ca2+、Ba2+ |
考点:微粒半径大小的比较,氧化性、还原性强弱的比较
专题:氧化还原反应专题,元素周期律与元素周期表专题
分析:A.同周期自左而右元素非金属性增强,元素原子氧化性增强,原子半径减小,电子层越多原子半径越大;
B.金属性越强阳离子氧化性越弱,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
C.非金属性越强阴离子还原性越强越弱,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
D.金属性越强阳离子氧化性越弱,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大.
B.金属性越强阳离子氧化性越弱,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
C.非金属性越强阴离子还原性越强越弱,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
D.金属性越强阳离子氧化性越弱,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大.
解答:
解:A.非金属性Cl>S>P,故氧化性Cl>S>P,自左而右原子半径减小,电子层越多原子半径越大,故原子半径:O<Cl<S<P,故A错误;
B.金属性K>Mg>Al>H,故氧化性K+<Mg2+<Al3+<H+,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:K+>Mg2+>Al3+>H+,故B正确;
C.非金属性S<I<Br<Cl,故离子还原性Cl-<Br-<I-<S2-,不表现氧化性,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径I->Br->S2->Cl-,故C错误;
D.金属性Al<Mg<Ca<Ba,故离子氧化性Al3+>Mg2+>Ca2+>Ba2+,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Al3+<Mg2+<Ca2+<Ba2+,故D错误,
故选B.
B.金属性K>Mg>Al>H,故氧化性K+<Mg2+<Al3+<H+,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:K+>Mg2+>Al3+>H+,故B正确;
C.非金属性S<I<Br<Cl,故离子还原性Cl-<Br-<I-<S2-,不表现氧化性,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径I->Br->S2->Cl-,故C错误;
D.金属性Al<Mg<Ca<Ba,故离子氧化性Al3+>Mg2+>Ca2+>Ba2+,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Al3+<Mg2+<Ca2+<Ba2+,故D错误,
故选B.
点评:本题考查微粒半径比较、氧化性与还原性强弱比较,难度中等,注意对元素周期律的理解掌握.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
下列与实验相关的叙述正确的是( )
| A、测定中和热时,应将NaOH溶液分次缓慢倒入装有盐酸的烧杯中,并搅拌 |
| B、配置溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 |
| C、酸碱滴定时,若加入待测前用待测液润洗锥形瓶,将导致测定结果偏高 |
| D、检验某溶液是否含有SO42-时,应取少量溶液,依次加入BaCl2溶液和稀盐酸 |
下列化学用语正确的是( )
A、氯化氢的电子式: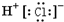 |
B、镁的原子结构示意图: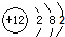 |
| C、乙酸的结构简式 C2H4O2 |
| D、碳酸钠的电离方程式 NaHCO3═Na++H++CO32- |
将0.5mol Na投入过量的水(m1g)中,得到a g溶液;将0.5mol Zn投入过量的盐酸(m2g)中,得到bg溶液,若m1═m2,则a.b的质量关系是( )
| A、a>b | B、a<b |
| C、a=b | D、不能确定 |
下列离子方程式中正确的是( )
| A、碳酸氢铵溶液与足量苛性钾溶液混合共热:NH4++OH-=NH3↑+H2O |
| B、Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| C、往硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-=CuS↓+H2S↑ |
| D、石灰石溶解在醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
在密闭容器中,一定量混合气体发生下列反应:aM(g)+bN(g)?cW(g),达一平衡后,测得M气体的浓度为0.5mol/L.当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L.则下列叙述正确的是( )
| A、W的体积分数降低 |
| B、平衡向右移动 |
| C、N的转化率提高 |
| D、反应速率增大 |