题目内容
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如表(KMnO4溶液用稀硫酸酸化),实验装置如图1:

实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.0lmol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |
(1)该反应的化学方程式为__________。
(2)该实验探究的是__________因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积
大小关系是__________ < __________ (填实验序号)。
(3)若实验①在2min末收集了 2.24mLCO2 (标准状况下),则在2min末,c(MnO4-) =__________ mol·L-1。(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定__________来比较化学反应速率。(一条即可)
(5)小组同学发现反应速率随时间的变化如图2所示,其中t1t2时间内速率变快的主要原因可能是:
①__________ ; ②__________ 。
【答案】 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O 浓度 ① ② 0.0056 KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间 该反应放热 产物Mn2+是反应的催化剂
【解析】(1)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,KMnO4和中锰降低了5价,1个H2C2O4分子中有2个+3价的C,所以升高1×2=2价,根据化合价升降总数相等可以确定KMnO4和H2C2O4的比例关系为:2:5,再根据电荷守恒配平离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)对比①②实验可探究草酸的浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,相同时间所得CO2的体积大;
(3)CO2的物质的量为: ![]() =0.0001mol,设2min末,反应消耗的n(MnO4-)为x,
=0.0001mol,设2min末,反应消耗的n(MnO4-)为x,
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
210
x0.0001mol
解得 x=0.00002mol
反应剩余的高锰酸根离子的物质的量为:30×10-3L×0.01molL-1-0.00002mol=0.00028mol
c(MnO4-)=![]() =
=![]() =0.0056mol/L;
=0.0056mol/L;
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率;
(5)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率;②产物Mn2+是反应的催化剂。

【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:

(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验__________(填“能”或“不能”)达到目的,原因是__________。(若能,不必回答原因)
(2)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2)
试管 | 夏 | II | III |
滴加试剂 | 5滴0.lmol·L-1FeCl3 | 5 滴 0.1mol·L-1 CuCl2 | 5 滴 0.3mol·L-1 NaCl |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
由此得到的结论是__________,设计实验Ⅲ的目的是__________。
(3)在上述实验过程中,分别检测出溶液中有二价铁生成,査阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是__________和__________(按反应发生的顺序写)。
【题目】下列给出的各组物质,不能完成下列转化的是( )
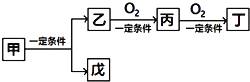
物质 选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | C6H12O6 | CH3CH2OH | CH3CHO | CH3COOH | CO2 |
B | NH4Cl | NH3 | N2 | NO2 | HCl |
C | NaCl | Na | Na2O | Na2O2 | Cl2 |
D | CH4 | C | CO | CO2 | H2 |
A. A B. B C. C D. D





