题目内容
下列说法正确的是( )
| A、电解质与非电解质的本质区别是在水溶液或熔化状态下能否电离 |
| B、盐酸的导电性一定比醋酸的强 |
| C、酸、碱和盐类都属于电解质,其他化合物都是非电解质 |
| D、溶于水能导电的化合物一定是电解质 |
考点:电解质与非电解质
专题:电离平衡与溶液的pH专题
分析:A.电解质能导电的原因是在水溶液或熔融状态下自身能电离出自由移动的离子;
B.盐酸的导电性不一定比醋酸的强,当醋酸中离子浓度大于盐酸时可实现;
C.根据电解质和非电解质的概念进行辨析解答;
D.溶于水能导电的化合物不一定是电解质,如三氧化硫;
B.盐酸的导电性不一定比醋酸的强,当醋酸中离子浓度大于盐酸时可实现;
C.根据电解质和非电解质的概念进行辨析解答;
D.溶于水能导电的化合物不一定是电解质,如三氧化硫;
解答:
解:A.依据化合物在水溶液或熔融状态下能否导电对化合物分类,能够导电的化合物为电解质,都不导电的化合物为非电解质,导电的原因为有自由移动的离子,本质区别是在水溶液或熔化状态下能否电离出自由移动的离子,故A正确;
B.溶液的导电能力与离子的浓度成正比,在相同条件下下,醋酸溶液的导电性比盐酸的弱,但当醋酸中离子浓度大于盐酸时,盐酸的导电性比醋酸的弱,故B错误;
C.电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;非电解质是指:在水溶液里和熔融状态下都不导电的化合物;单质、混合物既不是电解质也不是非电解质;,所以有的化合物不一定为非电解质,如氧化钙为电解质,故C错误;
D.溶于水能导电的化合物不一定是电解质,如SO3和水反应生成硫酸,硫酸能电离出自由移动的阴阳离子,所以三氧化硫的水溶液导电,但电离出离子的物质是硫酸不是三氧化硫,所以三氧化硫是非电解质,故D错误;
故选A.
B.溶液的导电能力与离子的浓度成正比,在相同条件下下,醋酸溶液的导电性比盐酸的弱,但当醋酸中离子浓度大于盐酸时,盐酸的导电性比醋酸的弱,故B错误;
C.电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;非电解质是指:在水溶液里和熔融状态下都不导电的化合物;单质、混合物既不是电解质也不是非电解质;,所以有的化合物不一定为非电解质,如氧化钙为电解质,故C错误;
D.溶于水能导电的化合物不一定是电解质,如SO3和水反应生成硫酸,硫酸能电离出自由移动的阴阳离子,所以三氧化硫的水溶液导电,但电离出离子的物质是硫酸不是三氧化硫,所以三氧化硫是非电解质,故D错误;
故选A.
点评:本题考查了电解质与非电解质的概念以及与导电间的关系,题目难度不大,注意电解质与非电解质的判断方法.电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质,溶液的导电能力与离子的浓度成正比.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案
相关题目
某研究小组开展课外研究发现,将适量Zn与一定浓度氯化铁溶液反应,开始可以观察到大量气泡产生.反应后期,溶液的pH升高到6左右,金属表面出现黑色粉末,溶液变成浅绿色.试管底部出现灰绿色悬浮物.收集少量黑色粉末与稀硫酸作用有气泡产生.则下列反应没有发生的是( )
| A、FeCl3+3H2O═Fe(OH)3↓+3HCl |
| B、Zn+2HCl═ZnCl2+H2↑ |
| C、3Zn+2FeCl3═3ZnCl2+2Fe |
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B、1L 1mol?L-1FeCl3溶液中Fe3+的数目小于NA |
| C、在18g 18O2中含有NA个氧原子 |
| D、22.4L氯气与足量镁粉充分反应,转移的电子数为2NA |
完全燃烧2mol某有机物,生成4mol CO2和6mol H2O,同时消耗5mol O2,该有机物的分子式为( )
| A、C2H6O2 |
| B、C2H4O |
| C、C2H6O |
| D、C2H6 |
下列物质中能与NaOH溶液反应的是( )
| A、Mg | B、Fe | C、Al | D、Cu |
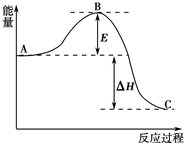 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.