题目内容
19.铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H20),为制取纯净的CuCl2•2H20,首先将其制成水溶液,然后按如图步骤进行提纯:
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
(1)最适合作氧化剂X的是C.
A.K2Cr207 B.NaCl0 C.H202 D.KMn04
(2)加入的物质Y是AC.
A.CuO B.NaOH C.Cu2(OH)2CO3 D.NH3
(3)由溶液Ⅲ获得CuCl2•2H2O,需要经过蒸发浓缩、冷却结晶、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用酸式(“酸式”或“碱式”)滴定管.反应的化学方程式:MnO4-+8H++5Fe2+=Mn2++5Fe3++4H2O.
分析 氯化亚铁和氯化铜的混合液中,加入氧化剂可以将亚铁离子氧化为铁离子,调节pH可以将铁离子沉淀,得到氯化铜的水溶液,然后再酸性环境下蒸发浓缩、冷却结晶,过滤、洗涤、干燥即可得到氯化铜晶体.
(1)加入氧化剂,将Fe2+氧化为Fe3+,易除去,选择的氧化剂不能引进新的杂质离子是最佳氧化剂;
(2)中和溶液的酸性,调节pH,将铁离子沉淀,铜离子不沉淀,可以加入CuO或Cu(OH)2、CuCO3、Cu2(OH)2CO3;
(3)从溶液中获得晶体要经过蒸发浓缩、冷却结晶、过滤三步操作;
(4)KMnO4溶液具有强氧化性,能腐蚀碱式滴定管的胶管;Fe2+与MnO4-反应,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,由电子守恒、电荷守恒、原子守恒解答.
解答 解:(1)根据实验目的,加入氧化剂的目的是将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离,K2Cr2O7、NaClO、H2O2、KMnO4都具有氧化性,能将亚铁离子氧化,但是K2Cr2O7、NaClO、KMnO4能引进新的杂质离子,双氧水是绿色氧化剂,得到的还原产物是水,不会引进杂质离子,
故答案为:C;
(2)加入的物质Y可调节,使Fe3+全部沉淀,同时不引进新杂质,铁离子在水中存在水解平衡:Fe3++3H2O?Fe(OH)3+3H+,用Cu(OH)2、CuCO3、CuO、Cu2(OH)2CO3等,
中和溶液的酸性,能促进水解平衡向正反应方向移动,调节pH,可以将铁离子沉淀(Fe3+氢氧化物完全沉淀时的PH:3.2),同时引入铜离子,无新的金属离子引入,且铜离子不沉淀(Cu2+氢氧化物开始沉淀时的PH:4.7),氢氧化钠和氨气都能使铜离子沉淀,无法分离Fe3+、Cu2+,
故答案为:AC;
(3)结晶水合物,为防止结晶水散失,从溶液中获得晶体通常采用降温结晶,所以从溶液中获得氯化铜晶体(CuCl2•2H20)要经过蒸发浓缩、冷却结晶、过滤三步操作,
故答案为:蒸发浓缩;冷却结晶;
(4)KMnO4溶液具有强氧化性,能腐蚀碱式滴定管的胶管,所以选择酸式滴定管,测定溶液Ⅰ中Fe2+的浓度,用KMnO4标准溶液滴定,Fe2+与MnO4-反应,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,由电子守恒、电荷守恒、原子守恒可知,离子反应为MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
故答案为:酸式;MnO4-+8H++5Fe2+=Mn2++5Fe3++4H2O.
点评 本题是一道物质的分离和提纯的实验方案设计题,题目考查的知识点较多,涉及氧化还原反应原理的应用、调节pH除杂质、盐的水解原理的应用等,考查学生分析解决问题以及灵活应用所学知识的能力,题目难度中等.

药品物理常数如表:
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
| 相对分子质量 | 106 | 102 | 148 | 60 |
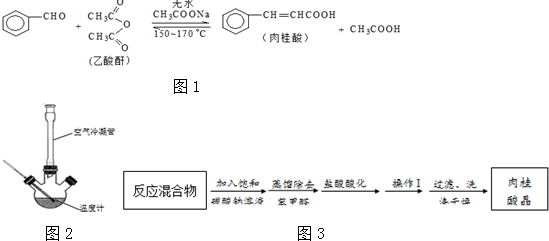
Ⅰ.合成:反应装置如图2所示.向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀. 在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
Ⅱ.粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行如图3操作:
(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是蒸发浓缩、冷却结晶;
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
(7)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是75%(保留两位有效数字).
| A. | 16O与18O互为同位素,H218O与D218O互为同素异形体,甲醇、乙二醇与丙三醇互为同系物 | |
| B. | 在SiO2晶体中,一个Si原子和2个O原子形成两个共价键 | |
| C. | 1L0.5mol/L 稀硫酸与1L 1mol/L 氢氧化钠溶液反应放出57.3kJ的热:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6 kJ/mol | |
| D. | 碳酸钠水溶液显碱性的原因:CO32-+2H2O?H2CO3+2OH- |
| A | KCl溶液(CaCl2) | 加K2CO3溶液,过滤,再加适量盐酸 |
| B | NaNO3溶液(AgNO3) | 加适量NaCl溶液,过滤 |
| C | NaCl溶液(I2) | 加酒精,分液 |
| D | KBr溶液(Br2) | 加CCl4,分液 |
| A. | A | B. | B | C. | C | D. | D |
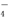 、NO
、NO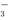 、Na+
、Na+ 、HCO
、HCO 、SO
、SO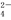 、AlO
、AlO
 澄清透明的溶液:Cu2+、Fe3+、SO
澄清透明的溶液:Cu2+、Fe3+、SO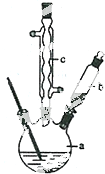 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: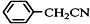 +H2O+H2SO4$\stackrel{100-130℃}{→}$
+H2O+H2SO4$\stackrel{100-130℃}{→}$ +NH4HSO4
+NH4HSO4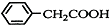 +Cu(OH)2→
+Cu(OH)2→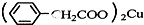 +H2O
+H2O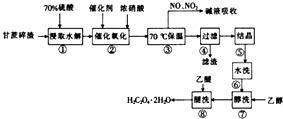 草酸是一种重要的化工原料,常用于有机合成,它属于二元弱酸,易溶于乙醇、水、微溶于乙醚.以甘蔗碎渣(主要成分为纤维素)为原料制取草酸的工艺流程如下:
草酸是一种重要的化工原料,常用于有机合成,它属于二元弱酸,易溶于乙醇、水、微溶于乙醚.以甘蔗碎渣(主要成分为纤维素)为原料制取草酸的工艺流程如下:
