题目内容
6.通过加入适量的化学药品,采用恰当的分离提纯方法,除去某溶液里溶解的杂质,下列做法中不正确的是(括号内的物质为杂质)( )| A | KCl溶液(CaCl2) | 加K2CO3溶液,过滤,再加适量盐酸 |
| B | NaNO3溶液(AgNO3) | 加适量NaCl溶液,过滤 |
| C | NaCl溶液(I2) | 加酒精,分液 |
| D | KBr溶液(Br2) | 加CCl4,分液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化钙与碳酸钾反应生成碳酸钙和KCl,过量碳酸钾与盐酸反应可除去;
B.硝酸银与NaCl反应生成氯化银沉淀和硝酸钠;
C.酒精与水互溶,不能作萃取剂;
D.溴易溶于四氯化碳,与KBr溶液分层.
解答 解:A.氯化钙与碳酸钾反应生成碳酸钙和KCl,过量碳酸钾与盐酸反应可除去,则加K2CO3溶液,过滤,再加适量盐酸可除杂,故A正确;
B.硝酸银与NaCl反应生成氯化银沉淀和硝酸钠,则反应后过滤可除杂,故B正确;
C.酒精与水互溶,不能作萃取剂,应选苯或四氯化碳作萃取剂,故C错误;
D.溴易溶于四氯化碳,与KBr溶液分层,则加CCl4,分液可除杂,故D正确;
故选C.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离方法选择等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
19.铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H20),为制取纯净的CuCl2•2H20,首先将其制成水溶液,然后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
请回答下列问题.
(1)最适合作氧化剂X的是C.
A.K2Cr207 B.NaCl0 C.H202 D.KMn04
(2)加入的物质Y是AC.
A.CuO B.NaOH C.Cu2(OH)2CO3 D.NH3
(3)由溶液Ⅲ获得CuCl2•2H2O,需要经过蒸发浓缩、冷却结晶、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用酸式(“酸式”或“碱式”)滴定管.反应的化学方程式:MnO4-+8H++5Fe2+=Mn2++5Fe3++4H2O.

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
(1)最适合作氧化剂X的是C.
A.K2Cr207 B.NaCl0 C.H202 D.KMn04
(2)加入的物质Y是AC.
A.CuO B.NaOH C.Cu2(OH)2CO3 D.NH3
(3)由溶液Ⅲ获得CuCl2•2H2O,需要经过蒸发浓缩、冷却结晶、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用酸式(“酸式”或“碱式”)滴定管.反应的化学方程式:MnO4-+8H++5Fe2+=Mn2++5Fe3++4H2O.
1.下列叙述完全正确的一组是( )
①气体摩尔体积约为22.4L•mol-1
②标准状况下,22.4L水中所含分子数为NA
③100mL O.1mol•L-1的H2S03溶液中,含有的离子数约为O.03NA
④常温常压下,1.6gO3所含的原子数为NA
⑤9g D2O中含有的电子数为5NA
⑥氦气的摩尔质量为8g.
①气体摩尔体积约为22.4L•mol-1
②标准状况下,22.4L水中所含分子数为NA
③100mL O.1mol•L-1的H2S03溶液中,含有的离子数约为O.03NA
④常温常压下,1.6gO3所含的原子数为NA
⑤9g D2O中含有的电子数为5NA
⑥氦气的摩尔质量为8g.
| A. | ①③④⑤ | B. | ④⑤⑦ | C. | ④ | D. | ①④ |
16. 如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl溶液和琼胶做成的冻胶)( )
如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl溶液和琼胶做成的冻胶)( )
 如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl溶液和琼胶做成的冻胶)( )
如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl溶液和琼胶做成的冻胶)( )| A. | 该原电池的总反应式为2Fe3++Cu=2Fe2++Cu2+ | |
| B. | 电池工作过程中,电子由铜电极经过电流表流向石墨电极 | |
| C. | 该电池工作时,Cu2+在电极上得到电子,发生还原反应 | |
| D. | 若用此电池电解饱和氯化钠溶液制取Cl2,当铜电极的质量减少6.4 g时,产生标准状况下氯气的体积为2.24 L |
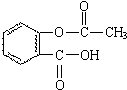 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关.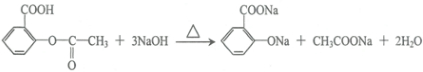 .
.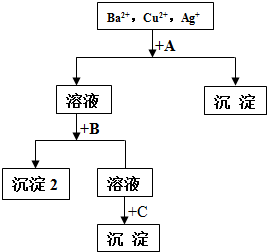 某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(写出最佳答案)
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(写出最佳答案) 如图是中学实验中常用到的仪器.
如图是中学实验中常用到的仪器.