题目内容
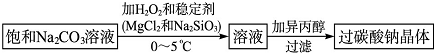
11.硅孔雀石是一种含铜的矿石,含铜形态为 CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质.以硅孔雀石为原料直接制取硫酸铜产品的工艺流程如图1所示:
请回答下列问题:
(1)写出氯渣A成份中除SiO2外还有H2SiO3(填化学式);
(2)步骤①中加入双氧水的作用是(用离子方程式表示)2Fe2++H2O2+2H+═2Fe3++2H2O
(3)步骤②调节溶液pH约为4,可以达到除去Fe3+而不损失CuSO4的目的,调节溶液pH可选用的最佳试剂是C
A.Fe(OH)3 B.NH3•H2O C.CuO D.NaOH
(4)已知常温下,Ksp[Al(OH)3]=3.2×10-34,测得滤液A中Al3+的浓度为1×10-2mol/L,则在滤渣B中有(填“有”或“没有”)Al(OH)3.
(5)为充分利用母液,某学生设计二种方案回收铜.
甲方案:如图2所示.
乙方案:按如图3所示装置进行电解.
乙方案中铜将在A(填“A”或“B”)极析出,为保持乙方案中电流恒定,B极应该使用铁(填“铁”或“石墨”)作电极材料.该方案和甲相比较,最大的缺点是耗能.
分析 硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质,硅孔雀石矿粉加入稀硫酸溶解,加入过氧化氢氧化亚铁离子浸取后过滤,得到滤渣A主要为SiO2、H2SiO3,滤液A含有Cu2+、Fe3+、Al3+、H+,加入铜的化合物调节溶液PH=4使铁离子全部沉淀,这样能不引入新杂质此时铝离子有部分沉淀,过滤得到滤液B主要是硫酸铜溶液,含有少量硫酸铝和硫酸溶液,通过蒸发浓缩蒸发,冷却结晶得到硫酸铜晶体,母液中加入铁粉,过滤可得铜,滤液中硫酸亚铁等,加入消石灰沉淀后排放,据此答题.
解答 解:硅孔雀石是一种含铜矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质,硅孔雀石矿粉加入稀硫酸溶解,加入过氧化氢氧化亚铁离子浸取后过滤,得到滤渣A主要为SiO2、H2SiO3,滤液A含有Cu2+、Fe3+、Al3+、H+,加入铜的化合物调节溶液PH=4使铁离子全部沉淀,这样能不引入新杂质此时铝离子有部分沉淀,过滤得到滤液B主要是硫酸铜溶液,含有少量硫酸铝和硫酸溶液,通过蒸发浓缩蒸发,冷却结晶得到硫酸铜晶体,母液中加入铁粉,过滤可得铜,滤液中硫酸亚铁等,加入消石灰沉淀后排放,
(1)根据上面的分析可知,A成份中除SiO2外还有H2SiO3,故答案为:H2SiO3;
(2)加入过氧化氢氧化亚铁离子,反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)根据上面的分析可知,调节溶液pH的同时不能引入新的杂质,所以可选用的最佳试剂是氧化铜,故选C;
(4)溶液pH约为4时,溶液中氢氧根离子的浓度为10-10mol/L,此时c(Al3+)•c3(OH-)=1×10-2×(10-10)3 =1×10-32>3.2×10-34,所以有氢氧化铝沉淀出现,
故答案为:有;
(5)根据电解原理,与电源负极相连的阴极上是溶液中的不活泼的金属离子得电子析出单质,所以要回收铜,则铜在阴极析出,为保持乙方案中电流恒定,即溶液中离子所带电荷的浓度不变,B极即阳极应该使用铁做电极,由于电解过程中要消耗电能,所以该方法和甲相比较,最大的缺点是耗能,
故答案为:A;铁;耗能.
点评 本题借助硅孔雀石为原料制取硫酸铜的工艺流程,考查了铜及其化合物性质分析判断,化学方程式计算应用,沉淀溶解原理的应用,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
(1)最适合作氧化剂X的是C.
A.K2Cr207 B.NaCl0 C.H202 D.KMn04
(2)加入的物质Y是AC.
A.CuO B.NaOH C.Cu2(OH)2CO3 D.NH3
(3)由溶液Ⅲ获得CuCl2•2H2O,需要经过蒸发浓缩、冷却结晶、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用酸式(“酸式”或“碱式”)滴定管.反应的化学方程式:MnO4-+8H++5Fe2+=Mn2++5Fe3++4H2O.
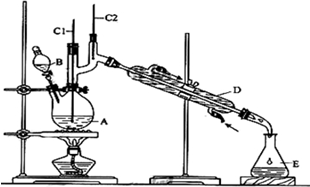
发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{2}}$CH3CH2CH2CHO
反应物和产物的相关数据如下:
| 沸点/℃ | 密度(g.cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(2)沸石的作用是防止暴沸.
(3)将正丁醛粗产品置于分液漏斗中分液时,水在下层(填“上”或“下”)
(4)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(5)本实验中,正丁醛的产率为51%.
| 实验步骤 | 加入试剂 | 离子方程式 |
| (1) | 稀HCl | CO32-+2H+=CO2↑+H2O |
| (2) | BaCl2溶液 | Ba2++SO42-=BaSO4↓ |
| (3) | AgNO3溶液 | Ag++Cl-=AgCl↓ |

 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关.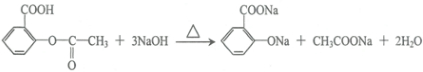 .
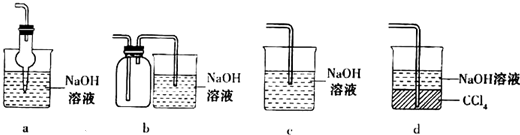
. 如图是中学实验中常用到的仪器.
如图是中学实验中常用到的仪器.