题目内容
4.以黄铜矿烧渣(含CuO、Fe2O3、FeO、SiO2、Al2O3)为主要原料,制备铁的多种化合物的流程如下:
(1)流程中硫酸的质量分数为30% (密度是1.176g/cm3),该硫酸的物质的量浓度为3.6mol•L-1.
(2)检验滤液A中存在Fe3+的方法是滴加KSCN溶液,如果溶液变血红色.
(3)加入足量铁粉的作用除调节pH使Al3+转化为Al(OH)3沉淀,还有两个作用,写出其中一个反应的离子方程式Fe+2Fe3+=3Fe2+或Fe+Cu2+=Fe2++Cu.
(4)流程②中除去绿矾晶体中所含杂质常采用冰水或乙醇洗涤.
(5)工业上通过在空气中煅烧FeCO3固体生产Fe2O3.写出反应的化学方程式4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
分析 本题是利用黄铜矿烧渣(含CuO、Fe2O3、FeO、SiO2、Al2O3)为主要原料,用硫酸溶解后,过滤除去SiO2,滤液用过量的铁粉置换出铜,并调节溶液pH得到Al(OH)3沉淀,通过过滤除去不溶物,得到的滤液主要是硫酸亚铁溶液,再将滤液通过蒸发浓缩、冷却结果得到FeSO47H2O,然后将绿矾溶解于水,向溶液里滴加纯碱溶液,可得到碳酸亚铁固体,整个流程涉及了反应原理的探究,及混合物的分离操作,还考查了质量分数与物质的量浓度之间的换算,据此可作答;
(1)可假设硫酸溶液的体积为1L,结合公式c=$\frac{n}{V}$计算硫酸的物质的量浓度;
(2)检验溶液里有无Fe3+,通常用KSCN溶液,现象明显,容易检验;
(3)加入足量铁粉的作用除调节pH使Al3+转化为Al(OH)3沉淀,还可以置换溶液里的铜,也可以将Fe3+还原成Fe2+;
(4)绿矾晶体表面附着的溶液,洗涤时要考虑减少晶体的溶解,可选择冷水或酒精洗涤;
(5)煅烧FeCO3固体生产Fe2O3的过程发生了氧化还原反应,且此过程为氧化过程,可考虑空气中的氧气参与了反应;
解答 (1)30%的硫酸溶液1L,溶液质量为1000mL×1.176g/cm3=1176g,硫酸的物质的量浓度为$\frac{\frac{1176g×30%}{98g/mol}}{1L}$=3.6g/mol,故答案为:3.6mol•L-1;
(2)向滤液A中滴加KSCN溶液,如果溶液变血红色,则证明存在Fe3+的,故答案为:滴加KSCN溶液,如果溶液变血红色;
(3)铁粉的作用除调节溶液pH外,还能与Cu2+和Fe3+反应,发生反应的离子方程式为Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu,故答案为:Fe+2Fe3+=3Fe2+或Fe+Cu2+=Fe2++Cu;
(4)选择用冷水或酒精洗涤绿矾晶体表面的溶液,可减少晶体本身的溶解,故答案为:冰水或乙醇;
(5)空气中的氧气参与了煅烧FeCO3固体生产Fe2O3的反应过程,反应的化学方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
点评 本题以实验流程为载体,考查硫及其化合物的性质,涉及氧化还原反应,属基础性考查,难度不大.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案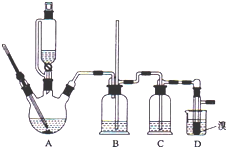 实验室制备 1,2-二溴乙烷的反应原理如下:
实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH→CH2=CH2+H2OC H2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到 170℃左右,其最主要目的是d;(填正确选 项前的字母)
a.引发反应b.加快反应速度c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置 C 中应加入NaOH溶液,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字母) a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的 Br2,最好用b洗涤除去(填正确选项前的字母);
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚.可用的方法除去蒸馏;
(7)反应过程中应用冷水冷却装置 D,其主要目的是冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
(1)最适合作氧化剂X的是C.
A.K2Cr207 B.NaCl0 C.H202 D.KMn04
(2)加入的物质Y是AC.
A.CuO B.NaOH C.Cu2(OH)2CO3 D.NH3
(3)由溶液Ⅲ获得CuCl2•2H2O,需要经过蒸发浓缩、冷却结晶、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用酸式(“酸式”或“碱式”)滴定管.反应的化学方程式:MnO4-+8H++5Fe2+=Mn2++5Fe3++4H2O.
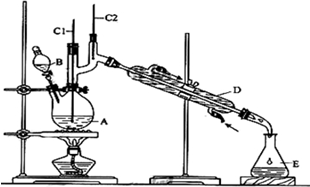
发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{2}}$CH3CH2CH2CHO
反应物和产物的相关数据如下:
| 沸点/℃ | 密度(g.cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(2)沸石的作用是防止暴沸.
(3)将正丁醛粗产品置于分液漏斗中分液时,水在下层(填“上”或“下”)
(4)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(5)本实验中,正丁醛的产率为51%.
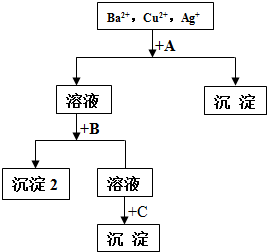 某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(写出最佳答案)
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(写出最佳答案)