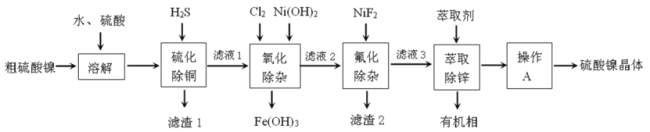
题目内容
【题目】铁、铜及其化合物应用广泛。回答下列问题:
(1)基态铁原子核外最后一个电子填充在__________(填能级符号),含有__________个成单电子,具有磁性。
(2)铁氰化钾![]() 是检验
是检验![]() 的重要试剂。
的重要试剂。
①铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为__________。
②铁氰化钾中,不存在__________(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
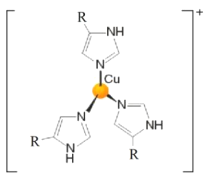
(3)血蓝蛋白是某些节肢动物体内能与氧气可逆结合的一种铜蛋白,其部分结构示意图如图。其中![]() 的化合价为_______价,
的化合价为_______价,![]() 的杂化类型是__________。
的杂化类型是__________。
(4)![]() 合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成
合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成![]() 合金的晶体结构图。在这种结构中,同一层的
合金的晶体结构图。在这种结构中,同一层的![]() 距离为
距离为![]() 。
。

①![]() 合金中
合金中![]() __________。
__________。
②同一层中,![]() 原子之间的最短距离是__________
原子之间的最短距离是__________![]() ,设
,设![]() 为阿伏加德罗常数的值,若要求算
为阿伏加德罗常数的值,若要求算![]() 晶体的密度,还需要知道的物理量是_________(钙、铜元素的相对原子质量为已知量)。
晶体的密度,还需要知道的物理量是_________(钙、铜元素的相对原子质量为已知量)。
【答案】3d 4 ![]() DE +1
DE +1 ![]() 5
5 ![]() 上下两层
上下两层![]() 之间的最短距离或上下两层
之间的最短距离或上下两层![]() 之间的最短距离
之间的最短距离
【解析】
(1)基态铁原子核外电子排布式为1s22s22p63s23p63d64s2,3d能级的能量高于4s能级,据此分析;
(2)①铁氰化钾中,所涉及的元素有Fe,K,C,N,金属原子的第一电离能小于非金属原子,同周期的C和N,第一电离能N>C,同周期的K,Fe,第一电离能呈现增大的趋势,由此判断;
②分析构成铁氰化钾配合物的粒子可知,该物质是离子化合物,含有CN-,CN-中存在C≡N三键;
(3)如结构示意图所示,其中![]() 与氮原子形成配位键,但一个单位正电荷,所带电荷来自于铜,与铜相结合的
与氮原子形成配位键,但一个单位正电荷,所带电荷来自于铜,与铜相结合的![]() 氮原子与碳原子形成碳氮双键,与氢结合的氮原子,成键电子对数为3,孤电子对数为1,结构类似氨气;
氮原子与碳原子形成碳氮双键,与氢结合的氮原子,成键电子对数为3,孤电子对数为1,结构类似氨气;
(4)①根据c图,利用均摊法计算![]() 合金中x;
合金中x;
②同一层中,六边形中心上的Ca原子和边上的两个Ca原子形成正三角形,所以Ca原子之间的最短距离是六边形边长=2×![]() ×(同层相邻Ca-Cu距离);计算晶胞的密度要计算晶胞的体积。
×(同层相邻Ca-Cu距离);计算晶胞的密度要计算晶胞的体积。
(1)基态铁原子核外电子排布式为1s22s22p63s23p63d64s2,3d能级的能量高于4s能级,则先填充4s能级,最后填充3d能级,根据泡利原理和洪特规则,3d能级上有4个单电子;
(2)①铁氰化钾中,所涉及的元素有Fe,K,C,N,金属原子的第一电离能小于非金属原子,同周期的C和N,第一电离能N>C,同周期的K,Fe,第一电离能呈现增大的趋势,由此判断;所以所涉及的元素的第一电离能由大到小的顺序为:N>C>Fe>K,
②铁氰化钾属于配合物,由K+、Fe3+和CN构成,是离子化合物,存在离子键,含有CN,CN中存在C≡N三键,一个C≡N由1个σ键和2个π键组成,化合物中不存在氢键和金属键,答案选DE;
(3)如结构示意图所示,其中![]() 与氮原子形成配位键,带一个单位正电荷,所带电荷来自于铜,其中
与氮原子形成配位键,带一个单位正电荷,所带电荷来自于铜,其中![]() 的化合价为+1价;与铜相结合的
的化合价为+1价;与铜相结合的![]() 氮原子与碳原子形成碳氮双键,为sp2杂化,与氢结合的氮原子,成键电子对数为3,孤电子对数为1,结构类似氨气,氮原子为sp3杂化;
氮原子与碳原子形成碳氮双键,为sp2杂化,与氢结合的氮原子,成键电子对数为3,孤电子对数为1,结构类似氨气,氮原子为sp3杂化;
(4)①该晶胞中Ca原子个数=12×![]() +2×
+2×![]() =3、Cu原子个数=12×
=3、Cu原子个数=12×![]() +6×
+6×![]() +6=15,则该晶胞中 Ca原子与Cu原子个数比为3:15=1:x,x=5;
+6=15,则该晶胞中 Ca原子与Cu原子个数比为3:15=1:x,x=5;
②同一层中,六边形中心上的Ca原子和边上的两个Ca原子形成正三角形,所以Ca原子之间的最短距离是六边形边长=2×![]() ×(同层相邻CaCu距离)=2×
×(同层相邻CaCu距离)=2×![]() ×294pm=294
×294pm=294![]() pm;计算晶胞的密度要计算晶胞的体积,晶胞层内六边形边长(Ca原子之间距离)已知,还需要知道层与层之间晶胞的边长,即上下两层Ca-Ca之间的最短距离或上下两层Ca-Cu之间的最短距离。
pm;计算晶胞的密度要计算晶胞的体积,晶胞层内六边形边长(Ca原子之间距离)已知,还需要知道层与层之间晶胞的边长,即上下两层Ca-Ca之间的最短距离或上下两层Ca-Cu之间的最短距离。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】二氧化碳资源化利用是目前研究的热点之一。
(1)二氧化碳可用于重整天然气制合成气(CO和H2)。
①已知下列热化学方程式:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206kJ/mol,CO2(g)+4H2(g)
CO(g)+3H2(g) △H1=+206kJ/mol,CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) △H 2=-165kJ/mol,
CH4(g)+2H2O(g) △H 2=-165kJ/mol,
则反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的△H=____kJ/mol。
2CO(g)+2H2(g)的△H=____kJ/mol。
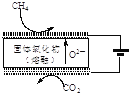
②最近我国学者采用电催化方法用CO2重整CH4制取合成气,装置如图所示。装置工作时,阳极的电极反应式为________。
(2)由二氧化碳合成VCB(锂电池电解质的添加剂)的实验流程如下,已知EC、VCB核磁共振氢谱均只有一组峰,均含五元环状结构,EC能水解生成乙二醇。
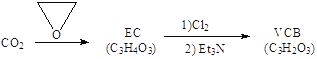
VCB的结构简式为_________。
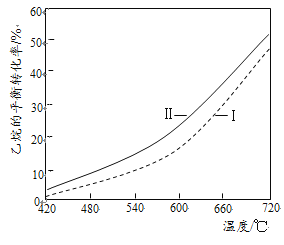
(3)乙烷直接热解脱氢和CO2氧化乙烷脱氢的相关化学方程式及平衡转化率与温度的关系如下:
(I)乙烷直接热解脱氢:C2H6(g)![]() C2H4(g)+H2(g) △H1
C2H4(g)+H2(g) △H1
(Ⅱ)CO2氧化乙烷脱氢:C2H6(g)+CO2(g)![]() C2H4(g)+CO(g)+H2O(g) △H2
C2H4(g)+CO(g)+H2O(g) △H2
①反应(I)的△H1= ____kJ/mol(填数值,相关键能数据如下表)。
化学键 | C-C | C=C | C-H | H-H |
键能/kJ·mol-1 | 347.7 | 615 | 413.4 | 436.0 |
②反应(Ⅱ)乙烷平衡转化率比反应(I)的大,其原因是______(从平衡移动角度说明)。
③有学者研究纳米Cr2O3催化CO2氧化乙烷脱氢,通过XPS测定催化剂表面仅存在Cr6+和Cr3+,从而说明催化反应历程为:C2H6(g)→C2H4(g)+H2(g),______和_______(用方程式表示,不必注明反应条件)。
④在三个容积相同的恒容密闭容器中,温度及起始时投料如下表所示,三个容器均只发生反应:C2H6(g)img src="http://thumb.zyjl.cn/questionBank/Upload/2019/10/07/08/dcc46cb6/SYS201910070801057716573811_ST/SYS201910070801057716573811_ST.001.png" width="33" height="10" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />C2H4(g)+H2(g)。温度及投料方式(如下表所示),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 600 | 600 | 500 |
反应物投入量 | 1molC2H6 | 2molC2H4+2molH2 | 1molC2H6 |
平衡时v正(C2H4)/ mol/(L·s) | v1 | v2 | v3 |
平衡时c(C2H4)/ mol/L | c1 | c2 | c3 |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是_______(填标号)。
A.K1=K2,v1<v2 B.K1<K3,v1< v3 C.v2>v3,c2>2c3 D.c2+c3<3c1