题目内容
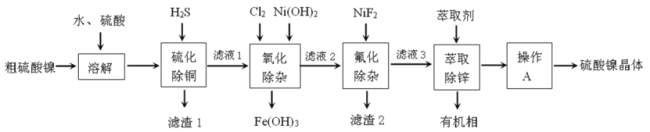
【题目】硫酸镍广泛应用于电镀、电池、催化剂等工业。某科研小组以粗硫酸镍(含![]() 等)为原料,经如图一系列除杂过程模拟精制硫酸镍工艺。回答下列问题。
等)为原料,经如图一系列除杂过程模拟精制硫酸镍工艺。回答下列问题。
(1)滤渣1的主要成分是__________(写化学式),写出“硫化除铜”过程生成含铜物质反应的离子方程式__________。
(2)“氧化除杂”时加入![]() 和
和![]() 的主要作用是__________。
的主要作用是__________。
(3)已知![]() 时,
时,![]() ;
;![]() 。则“氟化除杂”过后滤液3中
。则“氟化除杂”过后滤液3中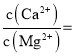 _____。
_____。
(4)“萃取”时使用萃取剂![]() 在硫酸盐中对某些金属离子的萃取率与溶液
在硫酸盐中对某些金属离子的萃取率与溶液![]() 的关系如图。则实验时需控制的
的关系如图。则实验时需控制的![]() 适宜范围是_____(填字母序号)。
适宜范围是_____(填字母序号)。
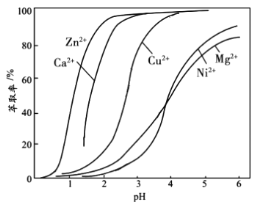
A.1~2 B.3~4 C.4~5 D.5~6
(5)将萃取后所得富含硫酸镍的溶液经操作A可得硫酸镍晶体,则操作A为___、___、过滤、洗涤等。
(6)称取![]() 硫酸镍晶体(
硫酸镍晶体(![]() )样品溶解,定容至
)样品溶解,定容至![]() 。取
。取![]() 试液,用
试液,用![]() 的
的![]() 标准溶液滴定至终点。重复实验,平均消耗
标准溶液滴定至终点。重复实验,平均消耗![]() 标准溶液体积为
标准溶液体积为![]() 。反应为
。反应为![]() 。计算样品纯度为_____。(不考虑杂质反应)
。计算样品纯度为_____。(不考虑杂质反应)
【答案】CuS和S H2S+ Cu2+=CuS↓+2H+ ![]() 的作用是将滤液中Fe2+氧化为Fe3+,
的作用是将滤液中Fe2+氧化为Fe3+,![]() 的作用是调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去 6.17×10-3 B 蒸发浓缩 降温结晶 96.0%
的作用是调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去 6.17×10-3 B 蒸发浓缩 降温结晶 96.0%
【解析】
粗硫酸镍(含![]() 等)加水和硫酸进行酸浸溶解,得到含有Ni2+、Cu2+、Fe3+、Ca2+、Mg2+、Zn2+、SO42-等离子的浸出液,向浸出液中通入H2S气体,Cu2+转化为CuS沉淀除去,同时Fe3+可与S2-发生氧化还原反应生成Fe2+和S单质,过滤后得到滤液1和滤渣1,滤渣1为CuS和S,滤液1中含有Ni2+、Fe2+、Ca2+、Mg2+、Zn2+、SO42-,向滤液1中加入Ni(OH)2和Cl2,Cl2将滤液中Fe2+氧化为Fe3+,用Ni(OH)2调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去,再进行过滤得到滤液2,向其中加入NiF2,使滤液2中的Ca2+、Mg2+转化为CaF2、MgF2沉淀除去,再次进行过滤得到滤液3,向滤液3中加入有机萃取剂,使滤液3中的Zn2+转移至有机相中分液除去,最后对水溶液进行蒸发浓缩、降温结晶、过滤、洗涤等操作得到产品硫酸镍晶体,据此分析解答。
等)加水和硫酸进行酸浸溶解,得到含有Ni2+、Cu2+、Fe3+、Ca2+、Mg2+、Zn2+、SO42-等离子的浸出液,向浸出液中通入H2S气体,Cu2+转化为CuS沉淀除去,同时Fe3+可与S2-发生氧化还原反应生成Fe2+和S单质,过滤后得到滤液1和滤渣1,滤渣1为CuS和S,滤液1中含有Ni2+、Fe2+、Ca2+、Mg2+、Zn2+、SO42-,向滤液1中加入Ni(OH)2和Cl2,Cl2将滤液中Fe2+氧化为Fe3+,用Ni(OH)2调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去,再进行过滤得到滤液2,向其中加入NiF2,使滤液2中的Ca2+、Mg2+转化为CaF2、MgF2沉淀除去,再次进行过滤得到滤液3,向滤液3中加入有机萃取剂,使滤液3中的Zn2+转移至有机相中分液除去,最后对水溶液进行蒸发浓缩、降温结晶、过滤、洗涤等操作得到产品硫酸镍晶体,据此分析解答。
(1)根据分析,滤渣1的主要成分是CuS和S,“硫化除铜”过程中,向浸出液中通入H2S气体,Cu2+转化为CuS沉淀除去,离子方程式H2S+ Cu2+=CuS↓+2H+;
(2)根据分析,“氧化除杂”时加入Cl2将滤液中Fe2+氧化为Fe3+,用Ni(OH)2调节溶液pH值,使滤液1中的Fe3+转化为氢氧化铁沉淀除去;
(3)已知![]() 时,
时,![]() ;
;![]() 。则“氟化除杂”过后滤液3中
。则“氟化除杂”过后滤液3中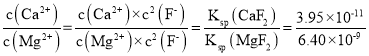 =6.17×10-3;
=6.17×10-3;
(4)在该工艺流程中,“萃取”操作的目的是使滤液3中的Zn2+转移至有机相中分液除去,流程的最终目的是制得硫酸镍,结合金属离子的萃取率与溶液![]() 的关系如图所示,当控制实验时的
的关系如图所示,当控制实验时的![]() 为3~4左右可以使滤液中的Cu2+、Ca2+、Zn2+等离子的萃取除杂率最好,故答案选B;
为3~4左右可以使滤液中的Cu2+、Ca2+、Zn2+等离子的萃取除杂率最好,故答案选B;
(5)根据分析,将萃取后所得富含硫酸镍的溶液经操作A可得硫酸镍晶体,则操作A为蒸发浓缩、降温结晶、过滤、洗涤等操作得到产品硫酸镍晶体;
(6)根据题意,取![]() 试液,消耗EDTA标准液的物质的量=0.02mol/L×0.0365L=7.3×10-4mol,根据反应
试液,消耗EDTA标准液的物质的量=0.02mol/L×0.0365L=7.3×10-4mol,根据反应![]() ,25mL试液中n(Ni2+)=n(EDTA)= 7.3×10-4mol,则250mL试液中硫酸镍晶体的质量=
,25mL试液中n(Ni2+)=n(EDTA)= 7.3×10-4mol,则250mL试液中硫酸镍晶体的质量=![]() ×7.3×10-4mol×263=1.9199g,则样品纯度为=
×7.3×10-4mol×263=1.9199g,则样品纯度为=![]() ×100%≈96%。
×100%≈96%。

【题目】下列实验现象与结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向未知液中滴加氯水,再滴加KSCN溶液 | 溶液呈红色 | 未知液中一定含有Fe2+ |
B | 向未知溶液中,先加入氢氧化钠溶液,加热,用润湿的红色石蕊试纸靠近。 | 试纸变蓝 | 无色溶液中含有NH |
C | 向某溶液中加入氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO |
D | 将银白色的金属钠放置在空气中 | 钠表面很快变暗 | 金属钠具有强氧化性 |
A.AB.BC.CD.D