题目内容
7.某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质.放电时的电池反应为:Li+LiMn2O4═Li2Mn2O4.下列说法正确的是( )| A. | 放电时,LiMn2O4发生氧化反应,电池内部Li+向正极移动 | |
| B. | 放电时,正极反应为:Li++LiMn2O4+e-═Li2Mn2O4 | |
| C. | 醋酸可用作锂离子电池的电解质 | |
| D. | 充电时,锂的碳材料为阳极且反应为:Li++e-═Li |
分析 根据电池总反应式Li+LiMn2O4═Li2Mn2O4,可知原电池放电时,Li为负极,被氧化,电极反应式为Li-e-═Li+,正极得电子被还原,电极反应式为Li++LiMn2O4+e-═Li2Mn2O4,以此解答该题.
解答 解:A.由总反应式可知,放电时,Mn元素化合价降低,LiMn2O4发生还原反应,电池内部Li+向正极移动,故A错误;
B.正极LiMn2O4得电子被还原,电极反应式为Li++LiMn2O4+e-═Li2Mn2O4,故B正确;
C.醋酸电离产生的氢离子比锂离子的氧化性强,如果醋酸作电解质,则锂离子不能放电,故C错误;
D.充电时,阳极发生氧化反应,Li2Mn2O4失电子被氧化,故D错误.
故选B.
点评 本题考查原电池知识,题目难度中等,本题注意明确电极反应方程式以及电极反应类型为解答该题的关键.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
14.海水是宝贵的自然资源,将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.
(1)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收0.15mol Br2时,转移的电子为0.25mol.
(2)海水提镁的一段工艺流程如图:
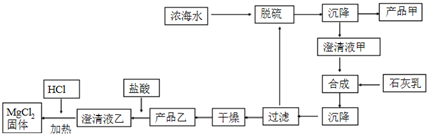
浓海水的主要成分如下:
①该工艺过程中,脱硫阶段主要的离子方程式为Ca2++SO42-=CaSO4↓,加入石灰乳时所发生的离子方程式是Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+
②产品乙的化学式为Mg(OH)2,1L浓海水最多可得到产品乙的质量是69.9g.
(1)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收0.15mol Br2时,转移的电子为0.25mol.
(2)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②产品乙的化学式为Mg(OH)2,1L浓海水最多可得到产品乙的质量是69.9g.
15.某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列叙述正确的是( )
| A. | 用pH试纸测得该消毒液的pH约为12 | |
| B. | 该消毒液中,Fe3+、K+、NO${\;}_{3}^{-}$、CH3CHO可以大量共存 | |
| C. | 向该消毒液中滴入少量Na2SO3溶液,反应的离子方程为:SO${\;}_{3}^{2-}$+ClO-=Cl-+SO${\;}_{4}^{2-}$ | |
| D. | 向该消毒液中加入浓盐酸,每产生1mol Cl2,转移电子数约为2×6.02×1023 |
19.硅烷是一类最简单的有机硅化合物,其分子组成与烷烃相似,下列说法中错误的是( )
| A. | 硅烷的分子通式为SinH2n+2 | B. | 甲硅烷燃烧生成二氧化硅和水 | ||
| C. | 甲硅烷的密度大于甲烷 | D. | 甲硅烷的热稳定性强于甲烷 |
17.下列关于有机化合物的说法中,正确的是( )
| A. | 有机物都不是电解质 | |
| B. | 所有的有机化合物都很容易燃烧 | |
| C. | 有机物中一定含有C元素,也可含H、N、S等元素 | |
| D. | 易溶于汽油、酒精、苯等有机溶剂的物质一定是有机化合物 |


 .
. ,
,