题目内容
5.四氯苯的同分异构体数目是( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 若将四氯苯的氢原子换成二氯苯的氯原子,将二氯苯的氢原子换成四氯苯的氯原子,这在算同分异构体时是等效的,即二氯苯有多少同分异构体,那么四氯苯就有多少同分异构体.
解答 解:二氯苯的同分异构体有3种:邻、间、对,二氯苯有多少同分异构体,四氯苯就有多少同分异构体,则四氯苯同分异构体的数目3种,故选:C.
点评 本题主要考查了同分异构体,等效思想的运用是解题的关键,难度不大.

练习册系列答案
相关题目
20.下列反应属于取代反应的是( )
| A. | 甲烷的燃烧 | B. | 由甲烷制取氯仿 | ||
| C. | 钠与水的反应 | D. | 硝酸银溶液与盐酸的反应 |
10.研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.
(1)二氧化碳合成甲醇是碳减排的新方向,已知:
①2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-677kJ•mol-1
以CO2和H2为原料合成甲醇的热化学方程式为CO2(g)+3H2 (g)=CH3OH(g)+H2O(g)△H=-49kJ•mol-1,
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
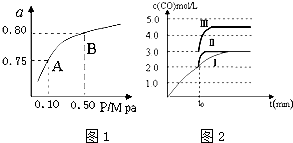
(3)判断反应③△H<0;△S<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆) (填“>”“=”或“<”)一定温度下,在3L容积可变的密闭容器中发生反应H2(g)+CO2(g)?H2O (g)+CO(g),已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池负极的电极反应式SO2-2e-+2H2O═SO42-+4H+.
(4)利用Na2SO3溶液充分吸收SO2制得NaHSO3溶液.
常温时吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
以下离子浓度关系的判断正确的是C
A.NaHSO3溶液中c(H+)<c(OH-)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)=c(H+)
D.当n(SO32-):n(HSO3-)=1:1时,c(Na+)=c(HSO3-)+2c(SO32-).
(1)二氧化碳合成甲醇是碳减排的新方向,已知:
①2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-677kJ•mol-1
以CO2和H2为原料合成甲醇的热化学方程式为CO2(g)+3H2 (g)=CH3OH(g)+H2O(g)△H=-49kJ•mol-1,
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||

(3)判断反应③△H<0;△S<0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)>v(逆) (填“>”“=”或“<”)一定温度下,在3L容积可变的密闭容器中发生反应H2(g)+CO2(g)?H2O (g)+CO(g),已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池负极的电极反应式SO2-2e-+2H2O═SO42-+4H+.
(4)利用Na2SO3溶液充分吸收SO2制得NaHSO3溶液.
常温时吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
A.NaHSO3溶液中c(H+)<c(OH-)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)=c(H+)
D.当n(SO32-):n(HSO3-)=1:1时,c(Na+)=c(HSO3-)+2c(SO32-).
17.下表中对离子方程式书写的评价正确的是( )
| 选项 | 化学反应与离子方程式 | 评价 |
| A | 将铜屑加入含Fe3+溶液中:Fe3++Cu═Fe2++Cu2+ | 正确 |
| B | Na2O2与H2O反应:Na2O2+H2O═2Na++2OH-+O2↑ | 错误,氧元素不守恒 |
| C | NaOH溶液与氧化铝反应:Al2O3+2OH-═2AlO2-+H2O | 错误,产物应该是Al(OH)3 |
| D | 向稀盐酸中加铁粉:Fe+2H+═Fe3++H2↑ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
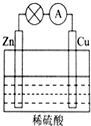 (1)如图所示的原电池装置中,其负极材料是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
(1)如图所示的原电池装置中,其负极材料是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.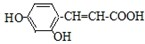 ;
;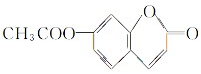 .
.