题目内容
8. 高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
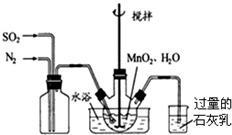
高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:(1)制备MnSO4溶液:在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤.
①写出左边集气瓶的作用混合SO2和N2.
②石灰乳的作用是:SO2+Ca(OH)2=CaSO3+H2O(用化学方程式表示)
③写出MnO2和H2SO3反应的离子反应方程式MnO2+H2SO3=Mn2++SO42-+H2O.
④反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有ac(选择选项填空).
a.缓慢通入混合气体 b.快速通入混合气体 c.控制适当的温度 d.高温加热
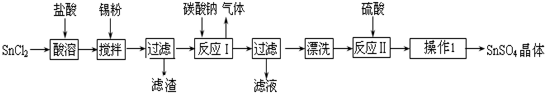
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7.请补充由(1)时制得的MnSO4制备高纯MnCO3的操作步骤.
【实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH】
①边搅拌边加入Na2CO3,并控制溶液pH<7.7;
②过滤,水洗2~3次;
③检验SO42-是否被洗涤干净.检验时是(填“是”或“否”)必须加盐酸酸化;
④用少量C2H5OH洗涤;
⑤低于100℃干燥.
分析 (1)①根据实验装置图可知,左边集气瓶的作用是混合SO2和N2;
②石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水;
③MnO2做氧化剂把亚硫酸氧化为硫酸,自身被还原为Mn2+,据此书写反应的离子方程式;
④为使SO2尽可能转化完全,一定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,据此答题.
解答 解:(1)①左边集气瓶的作用是混合SO2和N2 ,
故答案为:混合SO2和N2;
②石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水,反应为SO2+Ca(OH)2=CaSO3+H2O,
故答案为:SO2+Ca(OH)2=CaSO3+H2O;
③MnO2做氧化剂把亚硫酸氧化为硫酸,自身被还原为Mn2+,故反应的离子方程式为:MnO2+H2SO3=Mn2++SO42-+H2O,
故答案为:MnO2+H2SO3=Mn2++SO42-+H2O;
④使SO2尽可能转化完全,应定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢,故选ac;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,所以实验步骤为边搅拌边加入碳酸钠或碳酸氢钠,并控制溶液的PH<7.7、过滤,用水洗涤2-3次、检验SO42-是否被除去,此时必须用盐酸将溶液酸化,用少量的乙醇洗涤,
故答案为:过滤,水洗2~3次;是; C2H5OH.
点评 本题主要考查了制备高纯碳酸锰实验方案,读懂工艺流程,正确识图、理解离子反应的本质是解答的关键,本题实验综合性强,难度中等.

| A. | 0.1mol | B. | 1mol | C. | 0.3mol | D. | 3mol |
 苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯,有关物质的物理性质见表:
苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯,有关物质的物理性质见表:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 浓度/g•cm3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
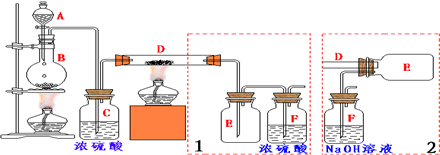
(1)甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制.
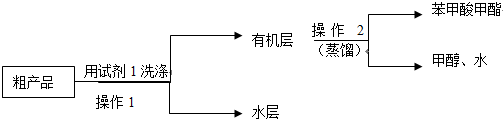
(2)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸.
A.稀硫酸 B.饱和碳酸钠溶液 C.乙醇
(3)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是C
A、蒸馏时从100℃开始收集产品
B、甲醇用量多了
C、制备粗品时苯甲酸被蒸出.
(4)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%.(结果保留三位有效数字)

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
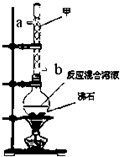
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下.
(3)请写出C装置中的离子反应方程式SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O.
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(5)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(6)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇挥发、副反应发生或反应太剧烈
(7)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,其原因是乙烯和液溴均易溶于四氯化碳.