题目内容
5.23.2g Fe3O4被浓硝酸氧化为Fe(NO3)3,失去电子( )| A. | 0.1mol | B. | 1mol | C. | 0.3mol | D. | 3mol |
分析 Fe3O4被浓硝酸氧化为Fe(NO3)3的过程是亚铁离子成为铁离子的过程,根据电子转移知识来计算.
解答 解:23.2g Fe3O4的物质的量$\frac{23.2g}{232g/mol}$=0.1mol,含有亚铁离子的物质的量是0.1mol,Fe3O4被浓硝酸氧化为Fe(NO3)3的过程是亚铁离子成为铁离子的过程,失去电子是0.1mol,故选A.
点评 本题考查血学生氧化还原反应和物质的量知识的有关计算,难度中等.

练习册系列答案
相关题目
15.实验室制取Cl2的反应为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,下列说法正确的是( )
| A. | 氧化剂是HCl,还原剂是MnO2 | |
| B. | 每生成2 mol Cl2,转移电子的物质的量是4 mol | |
| C. | 每消耗1 mol MnO2,表现还原作用的HCl为4 mol | |
| D. | Cl2既是氧化产物又是还原产物 |
20.以NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移4NA个电子 | |
| B. | 含有NA个“Cu”微粒的CuO和Cu2S混合物质量为80g | |
| C. | 常温常压下,2.24L CO2和SO2混合气中氧原子数为0.2NA | |
| D. | 100mL0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA |

 .
. Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 。
Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 。
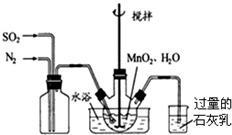 高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下: