题目内容
【题目】在两份相同的H2SO4溶液中,分别滴入物质的量浓度相等的Ba(OH)2、NaOH溶液,其导电能力随滴入溶液体积变化的曲线如下图所示,下列分析不正确的是

A. ①代表滴加Ba(OH)2溶液的变化曲线 B. a、c两点,溶液中均大量存在H+和SO42-
C. b、d两点对应的溶液均显中性 D. e点,两溶液中含有相同量的OH-
【答案】D
【解析】
根据化学反应过程中,离子浓度的变化分析溶液导电能力的变化。
向H2SO4溶液中滴入Ba(OH)2溶液时,发生反应H2SO4+Ba(OH)2=BaSO4↓+2H2O,随着Ba(OH)2溶液的滴入,溶液中H+、SO42-浓度减小,导电能力逐渐减弱,b点恰好反应时几乎不导电,之后过量的Ba(OH)2使溶液中Ba2+、OH-浓度增大,导电能力增强,故图中曲线①表示向H2SO4溶液中滴入Ba(OH)2溶液的情形(A项正确)。类似地,向H2SO4溶液中滴入NaOH溶液时,发生反应H2SO4+2NaOH=Na2SO4+2H2O,随着NaOH溶液的滴入,溶液总体积变大,溶液中离子浓度减小,导电能力逐渐减弱,d点恰好反应时导电能力最弱,之后过量的NaOH使溶液导电能力增强,曲线②表示向H2SO4溶液中滴入NaOH溶液的情形。
a、c两点,加入的碱均不足,溶液中均大量存在H+和SO42-(B项正确); b、d两点,酸碱恰好中和,对应的溶液均显中性(C项正确);曲线①上的e点,Ba(OH)2溶液已经过量,溶液中有OH-,曲线②上的e点,NaOH溶液不足,剩余H2SO4,溶液呈酸性(D项错误)。
本题选D。

【题目】N-苯基苯甲酰胺 广泛应用于药物,可由苯甲酸
广泛应用于药物,可由苯甲酸 与苯胺
与苯胺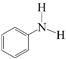 反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。
反应制得,由于原料活性低,可采用硅胶催化、微波加热的方式,微波直接作用于分子,促进活性部位断裂,可降低反应温度。取得粗产品后经过洗涤-重结晶等,最终得到精制的成品。
已知:
溶剂 物质 | 水 | 乙醇 | 乙醚 |
苯甲酸 | 微溶 | 易溶 | 易溶 |
苯胺 | 易溶 | 易溶 | 易溶 |
N-苯基苯甲酰胺 | 不溶 | 易溶于热乙醇,冷却后易于结晶析出 | 微溶 |
下列说法不正确的是
A. 反应时断键位置为C-O键和N-H键
B. 洗涤粗产品用水比用乙醚效果更好
C. 产物可选用乙醇作为溶剂进行重结晶提纯
D. 硅胶吸水,能使反应进行更完全
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。(夹持装置已略去)

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
填写下列空白:
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式: 。
D中发生反应的化学方程式为: 。
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象 。
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是 。
(5)若产物中有少量副产物乙醚.可用________(填操作名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是_____________。



