题目内容
3.将标准状况下VL的CO2气体通入500mL4mol/L的NaOH溶液中,下列对所得溶液的叙述不正确的是( )| A. | 当V<22.4L时,随着CO2气体的通入,溶液中由水电解出的c(H+)逐渐增大 | |
| B. | 当V=22.4L时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | |
| C. | 当22.4L<V<44.8L时,所得溶液中一定存在:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 当V=44.8L时,所得溶液中存在:c(OH-)+c(CO32-)=c(H+)+C(H2CO3) |
分析 500mL4mol/L的NaOH溶液中含有氢氧化钠的物质的量为:4mol/L×0.5L=2mol,标况下22.4L二氧化碳的物质的量为1mol,44.8L二氧化碳的物质的量为2mol,
A.氢氧根离子浓度越大,则水的电离程度越小;当V<22.4L时,二氧化碳的物质的量小于1mol,则氢氧化钠过量,反应生成碳酸钠,随着CO2气体的通入,溶液中氢氧根离子浓度逐渐减小;
B.当V=22.4L时,二氧化碳的物质的量为1mol,CO2和NaOH反应生成Na2CO3,c(OH-)由CO32-水解和水的电离两部分提供,则c(OH-)>c(HCO3-);
C.当22.4L<V<44.8L时,二氧化碳的物质的量大于1mol小于2mol,反应后的溶质为碳酸钠和碳酸氢钠,根据混合液中的物料守恒分析;
D.当V=44.8L时,二氧化碳为2mol,二者恰好反应生成碳酸氢钠,根据碳酸氢钠溶液中的质子守恒分析.
解答 解:500mL4mol/L的NaOH溶液中含有氢氧化钠的物质的量为:4mol/L×0.5L=2mol,标况下22.4L二氧化碳的物质的量为1mol,44.8L二氧化碳的物质的量为2mol,
A.当V<22.4L时,即二氧化碳小于1mol,氢氧化钠过量,反应生成碳酸钠,随着CO2气体的通入,溶液中氢氧根离子浓度逐渐减小,则溶液中由水电解出的c(H+)逐渐增大,故A正确;
B.当V=22.4L时,二氧化碳的物质的量为1mol,CO2和NaOH反应生成Na2CO3,c(OH-)由CO32-水解和水的电离两部分提供,则c(OH-)>c(HCO3-),溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故B正确;
C.当22.4L<V<44.8L时,二氧化碳的物质的量大于1mol小于2mol,反应后的溶质为碳酸钠和碳酸氢钠,根据混合液中的物料守恒可知,:c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3),故C错误;
D.当V=44.8L时,二氧化碳为2mol,二者恰好反应生成碳酸氢钠,根据碳酸氢钠溶液中的质子守恒可知:c(OH-)+c(CO32-)=c(H+)+C(H2CO3),故D正确;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理、质子守恒的含义及在判断离子浓度大小中的应用方法.

 阅读快车系列答案
阅读快车系列答案| A. | 1 mol Na2O2固体中含离子总数为3NA | |
| B. | 0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| C. | 40g NaOH溶于1L水中,所得NaOH 溶液的物质的量浓度为1mol/L | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
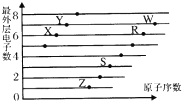 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )| A. | 该图体现出原子核外电子层呈现周期性变化 | |
| B. | 简单离子半径:W->R2->Z+>S3+ | |
| C. | R、Z形成的化合物中可能含有共价键 | |
| D. | 由酸性:HWO4>H2RO3可证明非金属性:W>R |
| A. | 二氧化硫使纸浆变白 | B. | 氯水使有色布条褪色 | ||
| C. | 活性炭使红墨水褪色 | D. | 漂白粉使某些染料褪色 |
 ”,当
”,当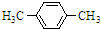 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$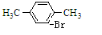 +HBr.
+HBr.