题目内容
12.(1)PCl3水解可制取亚磷酸:PCl3+3H2O=H3PO3+3HCl.(2)H3PO3溶液中存在电离平衡:H3PO3?H++H2P03-,某温度下,0.10mol•L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×10-2mol•L-1.求该温度下上述电离平衡的平衡常数K,写出计算过程.(H3PO3的第二步电离忽略不计,结果保留两位有效数字)
分析 (1)根据水解反应不是氧化还原反应,元素化合价没有变化,确定方程式中的生成物;
(2)据电离平衡常数K=$\frac{[{H}^{+}]•[{H}_{2}P{{O}_{3}}^{-}]}{[{H}_{3}P{O}_{3}]}$计算.
解答 解:(1)PCl3水解可制取亚磷酸和盐酸,水解方程式为:PCl3+3H2O?H3PO3+3HCl,故答案为:3HCl;
(2)H3PO3 ═H++H2PO3-
起始浓度 0.10 0 0
反应浓度 2.5×10-2 2.5×10-2 2.5×10-2
平衡浓度0.10-2.5×10-2 2.5×10-2 2.5×10-2
电离平衡常数K=$\frac{[{H}^{+}]•[{H}_{2}P{{O}_{3}}^{-}]}{[{H}_{3}P{O}_{3}]}$=$\frac{2.5×1{0}^{-2}×2.5×1{0}^{-2}}{0.10-2.5×1{0}^{-2}}$mol/L=8.3×10-3mol/L,
答:电离平衡的平衡常数K为8.3×10-3mol/L.
点评 本题考查了水解方程式的书写、化学平衡常数的求算,题目难度不大.

练习册系列答案
相关题目
3.将标准状况下VL的CO2气体通入500mL4mol/L的NaOH溶液中,下列对所得溶液的叙述不正确的是( )
| A. | 当V<22.4L时,随着CO2气体的通入,溶液中由水电解出的c(H+)逐渐增大 | |
| B. | 当V=22.4L时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | |
| C. | 当22.4L<V<44.8L时,所得溶液中一定存在:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 当V=44.8L时,所得溶液中存在:c(OH-)+c(CO32-)=c(H+)+C(H2CO3) |
7.下列有关实验说法错误的是( )
| A. | 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 | |
| B. | CO2中含少量SO2,可将该混合气体通入足量的饱和NaHCO3溶液中除去SO2 | |
| C. | 用洁净的铂丝蘸取某食盐,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐中不含KIO3 | |
| D. | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由浅红色变成红色,冷却后溶液由红色变成淡红色,说明HCO3-在水溶液中存在水解平衡 |
17.下列实验能达到预期实验目的是( )
| 实验 | 实验目的 | |
| A | 乙醇、乙酸与浓硫酸混合共热一段时间,对混合液直接蒸馏 | 制备纯净的乙酸乙酯 |
| B | 将某气体通入品红溶液,溶液褪色 | 检验气体中的SO2 |
| C | 测定等物质的量浓度的HCOOK和K2S溶液的pH | 比较Ka(HCOOH)和Ka2(H2S)的大小 |
| D | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和KMnO4溶液,观察气体产生的速度 | 比较CuSO4和KMnO4的催化效果 |
| A. | A | B. | B | C. | C | D. | D |

 一种有机化合物的结构简式为:
一种有机化合物的结构简式为: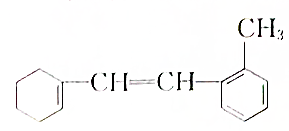 :
: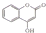 ,常用于制备抗凝血药,可通过下列流程合成:
,常用于制备抗凝血药,可通过下列流程合成:
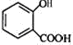 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$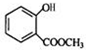 +H2O.
+H2O.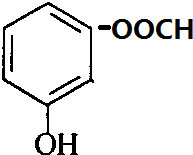 、
、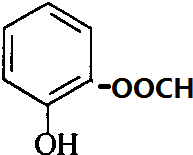 、
、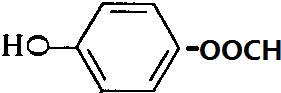 .
.