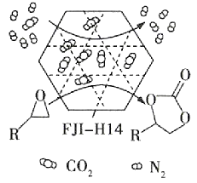
题目内容
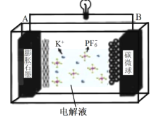
【题目】金属铜是被人们认识和利用较早的金属之一,西汉《淮南万毕术》中有“曾青得铁则化为铜”的记载,“曾青”是CuSO4溶液。回答下列问题:
(1)一些铜盐在灼烧时会产生特殊的颜色,原因是___。
(2)CuSO4溶液中,金属阳离子的最高能层符号为___;其中未成对电子数为___。
(3)CuSO4·5H2O可写成[Cu(H2O)4SO4]H2O,其结构如图所示:

①[Cu(H2O)4]2+中O原子的杂化类型为___。1mol[Cu(H2O)4]2+中含有σ键的个数为___(NA表示阿伏加德罗常数的值)。
②CuSO4·5H2O结构中含有的化学键的类型有___,所含元素的电负性大小顺序为___。
(4)金属铜的晶胞结构如图所示。
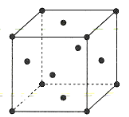
①该晶胞结构中含有由Cu原子构成的正八面体空隙和正四面体空隙,则正八面体空隙数和正四面体空隙数的比为___。
②科研发现硫化铜可以作为一种极为重要的P型半导体,其晶胞结构可以理解为铜晶胞中互不相邻的正四面体形成的空隙被S2-占据,若该晶体的密度为ag·cm-3,则两个最近的S2-之间的距离为___pm(NA表示阿伏加德罗常数的值)。
【答案】灼烧时基态铜原子的电子跃迁到较高能级,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以一定波长(可见光区域)的光的形式释放能量 M 1 sp3 12NA 配位键、共价键和离子键 O>S>H>Cu 1:2 ![]() ×
×![]() ×1010
×1010
【解析】
(1)铜盐在灼烧时会产生特殊的颜色,这是由于金属的焰色反应导致的:灼烧时基态铜原子的电子跃迁到较高能级,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以一定波长(可见光区域)的光的形式释放能量;
故答案为:灼烧时基态铜原子的电子跃迁到较高能级,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以一定波长(可见光区域)的光的形式释放能量;
(2)CuSO4溶液中,金属阳离子的核外电子排布式为:![]() ,最高能层符号是M,3d有5个轨道,根据洪特规则和泡利不相容规则,一个轨道最多容纳2个电子,故有1个未成对电子;
,最高能层符号是M,3d有5个轨道,根据洪特规则和泡利不相容规则,一个轨道最多容纳2个电子,故有1个未成对电子;
故答案为:M;1;
(3)①[Cu(H2O)4]2+中O原子的杂化类型,可直接分析水中氧原子的杂化方式,根据公式计算![]() ,故氧原子采取sp3杂化;1mol[Cu(H2O)4]2+中,每摩尔水含2molσ键,氧和铜形成1mol配位键,故1mol[Cu(H2O)4]2+中含有σ键的个数为12NA;
,故氧原子采取sp3杂化;1mol[Cu(H2O)4]2+中,每摩尔水含2molσ键,氧和铜形成1mol配位键,故1mol[Cu(H2O)4]2+中含有σ键的个数为12NA;
故答案为:sp3;12NA;
②根据CuSO4·5H2O的结构图可知,4个水和铜形成配位键,由原子提供孤对电子,水与硫酸根均含共价键,硫酸铜还含有离子键,故CuSO4·5H2O结构中含有的化学键的类型有配位键、共价键和离子键;根据元素周期律可知,元素周期表越靠近右上位置,电负性越强,故CuSO4·5H2O所含元素的电负性大小顺序为O>S>H>Cu;
故答案为:配位键、共价键和离子键;O>S>H>Cu;
(4)①晶胞中共有同一顶点的3个面心的微粒与顶点微粒形成正四面体,晶胞中正四面体数目为8;面心位置6个微粒围成正八面体,将晶胞补全可知共用1条棱的4个面心与该棱顶点微粒也围成正八面体,而这样的正八面体为4个晶胞共有,晶胞单独占有正八面体数目![]() ,故晶体中正八面体和正四面体空隙数的比值为
,故晶体中正八面体和正四面体空隙数的比值为![]() ;
;
②该硫化铜(CuS)晶体中,硫离子位于8个顶点和6个面心,故1个晶胞中硫离子数为:![]() ,铜离子个数也为4,则晶胞体积:
,铜离子个数也为4,则晶胞体积:![]() (pm3),两个最近的S2-是位于顶点和面心的位置,则两个最近的S2-之间的距离为边长的
(pm3),两个最近的S2-是位于顶点和面心的位置,则两个最近的S2-之间的距离为边长的![]() 倍,最近距离为:
倍,最近距离为:![]() ×
×![]() ×1010;
×1010;
故答案为![]() ×
×![]() ×1010。
×1010。

 名校课堂系列答案
名校课堂系列答案