题目内容
(12分)D、A、B、C为四种原子序数依次增大的短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族。已知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)C元素在周期表中的位置 周期 族。
(2)A、B元素形成的常见化合物水溶液显 性,原因是(用离子方程式表示) 用石墨做电极电解该化合物的水溶液,则阴极反应式为 ,
(3)A、D元素可以形成化合物A2D2,写出A2D2与CO2反应的化学方程式 (用元素符号表示)。该反应中还原剂是 。
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:① B(s)+O2(g)=BO2(g);△H=-296.8kJ/mol②2BO2(g)+O2(g) 2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol
则1 mol BO3(g)若完全分解成B(s),反应过程中的热效应为 。
(1)C元素在周期表中的位置 周期 族。
(2)A、B元素形成的常见化合物水溶液显 性,原因是(用离子方程式表示) 用石墨做电极电解该化合物的水溶液,则阴极反应式为 ,
(3)A、D元素可以形成化合物A2D2,写出A2D2与CO2反应的化学方程式 (用元素符号表示)。该反应中还原剂是 。
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:① B(s)+O2(g)=BO2(g);△H=-296.8kJ/mol②2BO2(g)+O2(g)
 2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol则1 mol BO3(g)若完全分解成B(s),反应过程中的热效应为 。
(1)第三周期第ⅦA族; (2)碱性;S2-+H2O HS-+OH-;2H++2e-=H2↑;
HS-+OH-;2H++2e-=H2↑;
(3) 2Na2O2+2CO2 =Na2CO3+ O2 ; Na2O2; (4)吸收395.1KJ的热量(或+395.1KJ)
 HS-+OH-;2H++2e-=H2↑;
HS-+OH-;2H++2e-=H2↑;(3) 2Na2O2+2CO2 =Na2CO3+ O2 ; Na2O2; (4)吸收395.1KJ的热量(或+395.1KJ)
试题分析:根据题意可知这几种元素分别是:A是Na;B是S;C是Cl;D是O。(1)Cl元素在周期表中的位置是位于第三周期第ⅦA族;(2)A、B元素形成的常见化合物Na2S是强碱弱酸盐,弱酸根离子水解使水溶液显碱性。水解的两种方程式为:S2-+H2O
 HS-+OH-;用石墨做电极电解该化合物的水溶液,由于放电能力H+>Na+,所以在阴极是H+得到电子。该电极的反应式为2H++2e-=H2↑;(3)Na2O2与CO2反应的化学方程式是2Na2O2+2CO2 =Na2CO3+ O2 ;在该反应中氧化剂、还原剂都是Na2O2。①×2+②足量可得BO3(g)="3/2" O2(g)+ B(s) ΔH=+395.1KJ/mol.
HS-+OH-;用石墨做电极电解该化合物的水溶液,由于放电能力H+>Na+,所以在阴极是H+得到电子。该电极的反应式为2H++2e-=H2↑;(3)Na2O2与CO2反应的化学方程式是2Na2O2+2CO2 =Na2CO3+ O2 ;在该反应中氧化剂、还原剂都是Na2O2。①×2+②足量可得BO3(g)="3/2" O2(g)+ B(s) ΔH=+395.1KJ/mol.
练习册系列答案
相关题目
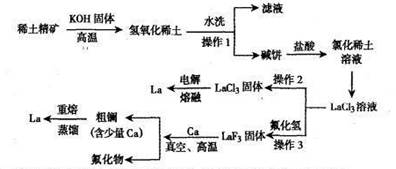

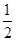 c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
 )>c(
)>c(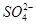 )>c(OH-)=c(H+)
)>c(OH-)=c(H+) )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)