题目内容
下列有关物质浓度关系的描述,正确的是
c(CH3COONa)> c(Na2CO3)>c(C6H5ONa)>c(NaHCO3)
| A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1 |
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c( )>c( )>c(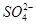 )>c(OH-)=c(H+) )>c(OH-)=c(H+) |
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c( )=c(H+)+c(H2CO3) )=c(H+)+c(H2CO3) |
| D.同温下,pH相同时,溶液物质的量浓度: |
A
25 ℃时,NaB溶液中根据电荷守恒可得:c(Na+)+c(H+)=c(B-)+c(OH-),则c(Na+)-c(B-)=c(OH-)-c(H+),根据NaB溶液的pH=8,则pOH=6,故c(Na+)-c(B-)=c(OH-)-c(H+)=1×10-6mol·L-1-1×10-8mol·L-1=9.9×10-7mol·L-1,A正确;向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液,首先发生的反应是2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O,此时c(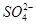 )=c(
)=c( ),但因为(NH4)2SO4是强酸弱碱盐,溶液呈酸性,若欲使溶液呈中性,则少量(NH4)2SO4继续与NaOH反应生成NH3·H2O,所以离子浓度关系应为c(Na+)>c(
),但因为(NH4)2SO4是强酸弱碱盐,溶液呈酸性,若欲使溶液呈中性,则少量(NH4)2SO4继续与NaOH反应生成NH3·H2O,所以离子浓度关系应为c(Na+)>c(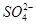 )>c(
)>c( )>c(OH-)=c(H+),B错误;0.1 mol·L-1的NaHCO3溶液中,电荷守恒式为c(OH-)+2c(
)>c(OH-)=c(H+),B错误;0.1 mol·L-1的NaHCO3溶液中,电荷守恒式为c(OH-)+2c( )+c(
)+c( )=c(H+)+c(Na+),物料守恒式为c(Na+)=c(
)=c(H+)+c(Na+),物料守恒式为c(Na+)=c( )+c(
)+c( )+c(H2CO3),所以c(OH-)+c(
)+c(H2CO3),所以c(OH-)+c( )=c(H+)+c(H2CO3),C错误;因为酸性:CH3COOH>H2CO3>C6H5OH>
)=c(H+)+c(H2CO3),C错误;因为酸性:CH3COOH>H2CO3>C6H5OH> ,则它们对应盐的水解程度c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3),所以同温下,pH相同时,溶液物质的量浓度:
,则它们对应盐的水解程度c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3),所以同温下,pH相同时,溶液物质的量浓度:
c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3),D正确。
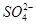 )=c(
)=c( ),但因为(NH4)2SO4是强酸弱碱盐,溶液呈酸性,若欲使溶液呈中性,则少量(NH4)2SO4继续与NaOH反应生成NH3·H2O,所以离子浓度关系应为c(Na+)>c(
),但因为(NH4)2SO4是强酸弱碱盐,溶液呈酸性,若欲使溶液呈中性,则少量(NH4)2SO4继续与NaOH反应生成NH3·H2O,所以离子浓度关系应为c(Na+)>c(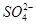 )>c(
)>c( )>c(OH-)=c(H+),B错误;0.1 mol·L-1的NaHCO3溶液中,电荷守恒式为c(OH-)+2c(
)>c(OH-)=c(H+),B错误;0.1 mol·L-1的NaHCO3溶液中,电荷守恒式为c(OH-)+2c( )+c(
)+c( )=c(H+)+c(Na+),物料守恒式为c(Na+)=c(
)=c(H+)+c(Na+),物料守恒式为c(Na+)=c( )+c(
)+c( )+c(H2CO3),所以c(OH-)+c(
)+c(H2CO3),所以c(OH-)+c( )=c(H+)+c(H2CO3),C错误;因为酸性:CH3COOH>H2CO3>C6H5OH>
)=c(H+)+c(H2CO3),C错误;因为酸性:CH3COOH>H2CO3>C6H5OH> ,则它们对应盐的水解程度c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3),所以同温下,pH相同时,溶液物质的量浓度:
,则它们对应盐的水解程度c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3),所以同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3),D正确。

练习册系列答案
相关题目
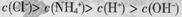
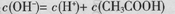

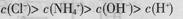
 2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol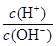 =10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是( )
=10-12。将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是( ) )>c(
)>c( )>c(OH-)
)>c(OH-)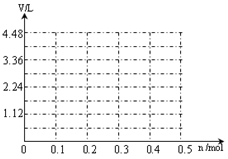 ’
’ 与Cl-浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
与Cl-浓度比为1∶1的溶液,可在NH4Cl溶液中加入( ) Al2O3
Al2O3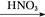 Al(NO3)3
Al(NO3)3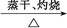 Al2O3
Al2O3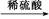 CuSO4溶液
CuSO4溶液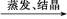 CuSO4·5H2O
CuSO4·5H2O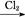 FeCl3
FeCl3 Fe(OH)3
Fe(OH)3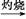 Fe2O3
Fe2O3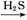 FeS
FeS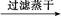 FeS
FeS NH3·H2O+H+
NH3·H2O+H+