题目内容
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
c(Na+)>c(NH4+)>c(SO42-)>c(OH-) =c(H+)
| A.在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.向0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合: c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.向0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: |
BC
试题分析:A、物料守恒, c(Na+) =2[c(S2-)+c(HS-) +c(H2S)],错误;B、电荷守恒,正确;C、反应生成KHCO3和等量的KCl,由于HCO3-水解和电离,其浓度小于氯离子,故有c(K+) >c(Cl-)>c(HCO3-),HCO3-以水解为主,溶液为碱性,正确;D、电荷守恒式为c(Na+)+c(NH4+)+ c(H+)=2c(SO42-)+c(OH-)即c(Na+)+c(NH4+)=2c(SO42-),所以c(SO42-)在c(Na+)、c(NH4+)之间,错误。

练习册系列答案
相关题目
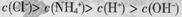
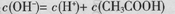

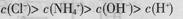
 2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol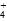 与Cl-浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
与Cl-浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )