题目内容
常温下,将20mL0.1mol/L的HCl溶液逐滴加入到20mL0.1mol/LNa2C2O4溶液中。已知NaHC2O4溶液显酸性,关于反应混合溶液的下列判断不正确的是
| A.c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4) |
B.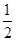 c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-) c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-) |
| C.c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(HC2O4) |
| D.加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小 |
C
试题分析:将20mL0.1mol/L的HCl溶液逐滴加入到20mL0.1mol/LNa2C2O4溶液中,生成NaHC2O4和NaCl。A、因为NaHC2O4溶液显酸性,HC2H4-的电离程度大于水解程度,所以浓度大小顺序为:c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4),正确;B、NaHC2O4产生的离子遵守电荷守恒,所以c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),正确;C、因为NaHC2O4和NaCl物质的量相等,所以c(Cl-)=c(HC2O4-)+c(C2O42-)+c(HC2O4),错误;D、加水稀释,H+浓度减小,因为H+和OH?浓度的乘积为常数,所以OH?浓度增大,正确。

练习册系列答案
相关题目

 2BO3(g);△H=-196.6kJ/mol
2BO3(g);△H=-196.6kJ/mol )>c(
)>c( )>c(OH-)
)>c(OH-) HC+OH-。下列说法正确的是( )
HC+OH-。下列说法正确的是( )