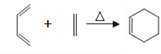题目内容
【题目】钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:

(1)钛铁矿在预处理时需要进行粉碎,其原因是___________________。
(2)过程①中反应的离子方程式是: FeTiO3 + 4H++ 4Cl-== Fe2+ + TiOCl42-+ 2H2O、_______。
(3)过程①中,铁的浸出率结果如图1所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是___________________。
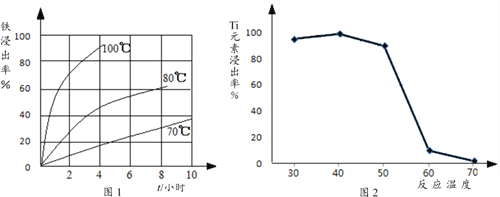
(4)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图2所示,反应温度过高时,Ti元素浸出率下降的原因是___________。
(5)在滤液B转化为FePO4沉淀过程中发生以下反应,请配平:
Fe2+ +_____ + H3PO4 ===FePO4 + ____ + _____
(6)过程③中由FePO4制备LiFePO4的化学方程式是_________________________。
【答案】 增大反应物接触面积,加快反应速率。 MgO+2H+====Mg2++H2O 100℃ 3小时 温度过高,双氧水分解与氨气逸出导致Ti元素浸出率下降 2Fe2++ H2O2+ 2H3PO4 == 2FePO4 + 4H++ 2H2O 2FePO4+ Li2CO3+ H2C2O4![]() 2LiFePO4+ 3CO2↑+ H2O
2LiFePO4+ 3CO2↑+ H2O
【解析】(1)钛铁矿在预处理时需要进行粉碎,以增大反应物接触面积,加快反应速率;(2)过程①中铁钛矿中FeTiO3及MgO与盐酸反应,反应的离子方程式是: FeTiO3 + 4H++ 4Cl-== Fe2+ + TiOCl42-+ 2H2O、MgO+2H+====Mg2++H2O;(3)过程①中,铁的浸出率结果如图1所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是100℃ 3小时;(4)反应温度过高时,Ti元素浸出率下降的原因是温度过高,双氧水分解与氨气逸出导致Ti元素浸出率下降;(5)在滤液B转化为FePO4沉淀,过程中亚铁离子被氧化为铁离子,同时溶液酸性增强,发生反应为:2Fe2++ H2O2+ 2H3PO4 == 2FePO4 + 4H++ 2H2O;(6)过程③中由FePO4制备LiFePO4的化学方程式是2FePO4+ Li2CO3+ H2C2O4![]() 2LiFePO4+ 3CO2↑+ H2O。
2LiFePO4+ 3CO2↑+ H2O。

【题目】某学习小组探究铁和硝酸银溶液的反应,实验过程如下:
实验序号 | 实验操作 | 实验现象 |
I | 将一束光亮洁净的铁丝伸入到0.1mol/L 的AgNO3溶液中 | 铁丝表面有银白色固体析出,溶液逐渐变为浅绿色 |
II | 取少量实验I中上层清液,滴入K3[Fe(CN) 6]溶液 | 有蓝色沉淀生成 |
(1)根据上述实验现象,甲同学认为有Fe2+生成,铁和硝酸银溶液的反应的离子方程式是____________________。
(2)乙同学认为实验中可能生成Fe3+,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
III | 取少量实验I中上层清液,滴入少量KSCN溶液,振荡 | 产生白色沉淀,溶液局部变红,振荡后红色消失,沉淀量增加 |
查阅资料:Ag+与SCN-生成白色沉淀AgSCN
乙同学判断有Fe3+,理由是 ____________________。
(3)乙同学继续探究红色褪去的原因,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
IV | 取少量实验I中上层清液,滴加几滴稀盐酸 | 有白色沉淀生成 |
V | 取1mLFe(NO3)3溶液,滴加2滴等浓度的KSCN溶液,振荡,再滴加少量AgNO3溶液 | 溶液变红;振荡溶液颜色无变化,滴加AgNO3后溶液红色褪去,产生白色沉淀. |
① 实验IV的目的是____________________;
② 用平衡移动原理解释,实验V中溶液红色褪去的原因____________________。
(4)丙认为溶液中Fe3+是Fe2+被Ag+氧化所致。按下图连接装置并进行实验,一段时间后取出左侧烧杯溶液加入KSCN溶液,溶液变红

① 其中X溶液是____________________;
② 由实验得出Ag+和Fe2+反应的离子方程式是____________________;
③ 丙同学的实验设计及结论是否合理,请说明理由____________________。
【题目】海水中蕴藏着丰富的资源,海水综合利用的流程图如图1: 
(一)某化学研究小组用图装置2模拟步骤I电解食盐水 (用铁和石墨做电极).
(1)a电极材料是(填铁、石墨),其电极反应式为 .
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为(忽略反应前后溶液体积的变化). (二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+ . 表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+ , 最适宜选用的物质是(填序号,下同),加入调节溶液的pH,充分反应后过滤,可得MgCl2溶液. a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2H2O获得MgCl2的操作是: .