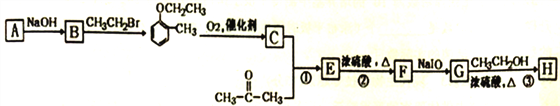
题目内容
【题目】易形成简单阳离子的元素是( )
A. Cl B. Ne C. Na D. S
【答案】C
【解析】A、氯为非金属元素,最外层为7个电子,易得电子,形成Cl-,故A错误;B、Ne为稀有气体元素,最外层为8个电子,既难得电子,也难失去电子,故B错误;C、Na为金属元素,最外层为1个电子,易失去电子,形成Na+,故C正确;D、硫为非金属元素,最外层为6个电子,易得电子,形成S2-,故D错误;故选C。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】海水中蕴藏着丰富的资源,海水综合利用的流程图如图1: 
(一)某化学研究小组用图装置2模拟步骤I电解食盐水 (用铁和石墨做电极).
(1)a电极材料是(填铁、石墨),其电极反应式为 .
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为(忽略反应前后溶液体积的变化). (二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+ . 表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+ , 最适宜选用的物质是(填序号,下同),加入调节溶液的pH,充分反应后过滤,可得MgCl2溶液. a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2H2O获得MgCl2的操作是: .
【题目】氮是生产硝酸、尿素等物质的重要原料。
(1)氨催化氧化法是工业制硝酸的主要方法。已知:
2NO(g)+3H2(g) ![]() 2NH3(g)+02(g) △H1=-272.9kJ/mol
2NH3(g)+02(g) △H1=-272.9kJ/mol
2H2(g)+02(g)![]() 2H2O(g) △H2=-483.6kJ/mol
2H2O(g) △H2=-483.6kJ/mol
则4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H3=__________
4NO(g)+6H2O(g) △H3=__________
(2)恒容密闭容器中进行合成知反应:N2(g)+3H2(g)![]() 2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
温度/K | 298 | 398 | 498 | … |
平衡常数(K) | 4.1×106 | K1 | K2 | … |
K1____K2(填“>”或“<”),其判断理由是_____________。
(3)向氨合成塔中充入10molN2和40molH2合成氨,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。
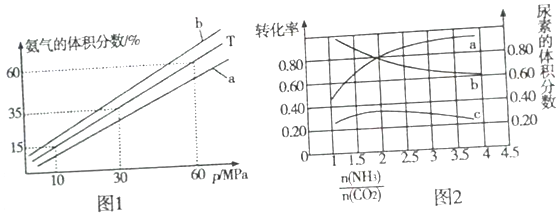
①下列说法正确的是______(填字母)。
A.由图1可知增大体系压强(p)有利于增大氨气在混合气体中的体积分数
B.若图1中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度的主要目的是提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
②当温度为T、氨气的体积分数为25%时,N2的转化率为__________。
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后得到溶液中溶质的质量分数为_______。
(5)氮碳比[![]() ]对合成尿素的反应:2NH3(g)+CO2(g)
]对合成尿素的反应:2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当
CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当![]() =_______时,尿素的产量最大,该条件下反应的平衡常数K=________。
=_______时,尿素的产量最大,该条件下反应的平衡常数K=________。