��Ŀ����
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����о� ��������������Ϊ���ǹ�ͬ��ע�Ŀ��⡣
��1��2NO��g��+O2��g��2NO2��g���ķ�Ӧ�������£�
��Ӧ��2NO��g��N2O2��g�����죩��v1����k1��c2��NO����v1����k1��c��N2O2����
��Ӧ��N2O2��g��+O2��g��2NO2��g����������v2����k2��c��N2O2��c��O2����v2����k2��c2 ��NO2����
��һ�������£���Ӧ2NO��g��+O2��g��2NO2��g���ﵽƽ��״̬��ƽ�ⳣ��K��_____���ú�k1����k1����k2����k2���Ĵ���ʽ��ʾ����
��2���̵����е�NOx����Ҫ�Ĵ�����Ⱦ��֮һ��Ϊ�˼���京����ѡ�����¼�ⷽ����
��v L����ͨ�������ữ��H2O2��Һ�У�ʹNO��ȫ��������NO3������ˮϡ����100.00 mL����ȡ20.00 mL����Һ������v1 mL c1 molL��1 FeSO4����Һ������������ַ�Ӧ����c2 molL��1 K2Cr2O7����Һ�ζ�ʣ���Fe2+���յ�ʱ����v2 mL��
��NO��H2O2����ΪNO3�� �����ӷ���ʽΪ________��
�ڼ�ˮϡ�͵�100.00mL���õIJ�����������Ͳ���ձ�������������ͷ�ι��⣬����Ҫ_____��
�۵ζ������з������з�Ӧ��
3Fe2++NO3��+4H+�TNO��+3Fe3++2H2O
Cr2O72��+6Fe2++14H+�T2Cr3++6Fe3++7H2O
��������NO�ĺ���Ϊ_____mg/L��
���в�����ʹ�ζ����ƫ�ߵ���_____
A���ζ���δ�ñ�Һ��ϴ
B����ƿϴ������������ˮ
C���ζ��ܵζ�ǰ������ȷ���ζ����Ӷ���
D��FeSO4����Һ���ֱ���
���𰸡�![]() 2NO+3H2O2 �T 2H++2NO3��+2H2O 100mL����ƿ
2NO+3H2O2 �T 2H++2NO3��+2H2O 100mL����ƿ ![]() CD
CD
��������
�Ž���������ʽ��ӣ���ƽ�ⳣ����ˡ�
����NO��H2O2��Ӧ����NO3����ˮ������Ҫ��100mL����ƿ������Һ�������ݷ���ʽ���õ��ظ�������ĵ��������ӵ����ʵ���Ϊn(Fe2+)���ٵõ���������ĵ��������ӵ����ʵ���Ϊn(Fe2+)���ٸ��ݹ�ϵʽNO ��NO3���� 3Fe2+���õ�n(NO)���ټ���Ũ�ȡ�
��A���ζ���δ�ñ�Һ��ϴ�����������ı�Һ������ӣ��������Һ���������������࣬����������ĵ���������ƫ�٣�NO����ƫ�ͣ�B����ƿϴ������������ˮ���Խ����Ӱ�죻C���ζ��ܵζ�ǰ������ȷ���ζ����Ӷ������������ı�ҺƫС����Һ������������ƫС�������������������ƫ�࣬NO����ƫ�ߣ�D��FeSO4����Һ���ֱ��ʣ����ı�Һ���ƫС���������Һ������������ƫС�������������������ƫ�࣬NO����ƫ�ߡ�
�ŷ�Ӧ����2NO(g) N2O2(g)���죩��![]() ����Ӧ����N2O2(g)+O2(g) 2NO2(g)��������
����Ӧ����N2O2(g)+O2(g) 2NO2(g)��������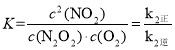 ������������ʽ��ӣ���ƽ�ⳣ����ˣ������һ�������£���Ӧ2NO(g)+O2(g)2NO2(g)�ﵽƽ��״̬��ƽ�ⳣ��
������������ʽ��ӣ���ƽ�ⳣ����ˣ������һ�������£���Ӧ2NO(g)+O2(g)2NO2(g)�ﵽƽ��״̬��ƽ�ⳣ��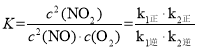 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
����NO��H2O2��Ӧ����NO3����ˮ�������ӷ���ʽΪ2NO + 3H2O2 ��2H++2NO3��+2H2O���ʴ�Ϊ��2NO + 3H2O2 ��2H++2NO3��+2H2O��
����ˮϡ�͵�100.00mL���õIJ�����������Ͳ���ձ�������������ͷ�ι��⣬����Ҫ100mL����ƿ���ʴ�Ϊ��100mL����ƿ��
�����ݷ���ʽCr2O72 + 6Fe2+ + 14H+�� 2Cr3+ + 6Fe3+ + 7H2O���õ��ظ�������ĵ��������ӵ����ʵ���Ϊn(Fe2+)= 6��c2 mol��L1��v2��103 L = 6c2v2��103 mol������������ĵ��������ӵ����ʵ���Ϊn(Fe2+)= c1 mol��L1��v1��103 L 6c2v2��103 mol =( c1v1 6c2v2)��103mol���ٸ��ݹ�ϵʽNO ��NO3���� 3Fe2+���õ�n(NO) = ![]() ( c1v1 6c2v2)��103mol����������NO�ĺ���Ϊ
( c1v1 6c2v2)��103mol����������NO�ĺ���Ϊ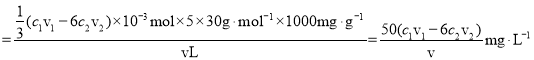 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��A���ζ���δ�ñ�Һ��ϴ�����������ı�Һ������ӣ��������Һ���������������࣬����������ĵ���������ƫ�٣�NO����ƫ�ͣ���A���������⣻B����ƿϴ������������ˮ���Խ����Ӱ�죬��B���������⣻C���ζ��ܵζ�ǰ������ȷ���ζ����Ӷ������������ı�ҺƫС����Һ������������ƫС�������������������ƫ�࣬NO����ƫ�ߣ���C�������⣻D��FeSO4����Һ���ֱ��ʣ����ı�Һ���ƫС���������Һ������������ƫС�������������������ƫ�࣬NO����ƫ�ߣ���D�������⣻������������Ϊ��CD��

����Ŀ����ȩ��ľ�ļӹ���ҽҩ�ȷ�������Ҫ��;���״�ֱ�������ǹ�ҵ�Ϻϳɼ�ȩ���·������Ʊ������漰����Ҫ��Ӧ���£�
��ӦI��CH3OH(g)![]() HCHO(g)+H2(g) ��H1=+85.2kJ��mol��1
HCHO(g)+H2(g) ��H1=+85.2kJ��mol��1
��ӦII��CH3OH(g)+1/2O2(1)![]() HCHO(g)+H2O(g) ��H2
HCHO(g)+H2O(g) ��H2
��ӦIII��H2(g)+1/2O2(g)![]() H2O(g) ��H3=��241.8kJ��mol��1
H2O(g) ��H3=��241.8kJ��mol��1
����Ӧ��
��ӦIV��CH3OH(g)+O2(g)![]() CO(g)+2H2O(g) ��H4=��393.0kJ��mol��1
CO(g)+2H2O(g) ��H4=��393.0kJ��mol��1
��1�����㷴Ӧ���ķ�Ӧ����H2=____________________________________________��
��2��750K�£��ں����ܱ������У�������ӦCH3OH(g)![]() HCHO(g)+H2(g��������ʼѹǿΪP0���ﵽƽ��ת����Ϊ������ƽ��ʱ����ѹǿPƽ=___________(�ú�P0������ʽ�ӱ�ʾ)����P0=101kPa�������=50.0%�����㷴Ӧƽ�ⳣ��Kp=___________kPa(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������������Ӧ)��
HCHO(g)+H2(g��������ʼѹǿΪP0���ﵽƽ��ת����Ϊ������ƽ��ʱ����ѹǿPƽ=___________(�ú�P0������ʽ�ӱ�ʾ)����P0=101kPa�������=50.0%�����㷴Ӧƽ�ⳣ��Kp=___________kPa(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������������Ӧ)��
��3��Na2CO3�Ǽ״������Ƽ�ȩ�Ĵ��������о�ָ��������Ӧ�IJ��ֻ������£�
����i��CH3OH��H+��CH2OH
����������CH2OH����H+HCHO
����������CH2OH��3��H+CO
����iv����H+��H��H2
��ͼ��ʾһ���������¶ȶ�̼���ƴ��������ܵ�Ӱ�죬�ش��������⣺

�ٴ�ƽ��ǶȽ���550��-650���״����ɼ�ȩ��ת�������¶����ߵ�ԭ��___________��
�ڷ�Ӧ����i�Ļ��___________(����>����<������=��)CH3OH(g)![]() HCHO(g)+H2(g)��ܡ�
HCHO(g)+H2(g)��ܡ�
��650��~750������Ӧ����ii������___________(����>������<������=��)��Ӧ�����������ʡ�
��4�������Ǵ�����ȩ��ˮ��һ�ֹ��գ��������ʿ��÷���v=0.0423c(mg��L��1��h��1)��ʾ(����cΪ��ȩŨ��)���±�Ϊ�����¼�ȩ��Ũ���洵��ʱ��仯���ݡ�
Ũ��(mg/L) | 10000 | 8000 | 4000 | 2000 | 1000 |
����ʱ��(h) | 0 | 7 | 23 | 39 | 55 |
��ȩŨ��Ϊ2000mg/Lʱ���䴵������v=___________ mg��L��1��h��1�������ϱ����ݣ���ʼŨ��Ϊ10000mg/L������ȩŨ�Ƚ�Ϊ5000mg/L������ʱ��Ϊ___________h��