题目内容
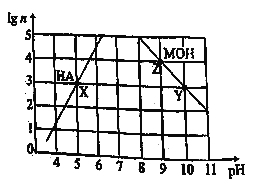
【题目】根据下图所示,下列说法正确的是

A.甲池是电能转化为化学能的装置,乙、丙是化学能转化为电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D.甲池中消耗280mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
【答案】D
【解析】
A.甲电池是原电池,是化学转化为电能的装置,乙、丙池是电能转化为化学能的装置,A错误;
B.甲池通入CH3OH的电极是原电池的负极,发生氧化反应,其电极反应式CH3OH-6e-+8OH-=CO32-+6H2O,B错误;
C.乙池中,石墨与原电池的正极相连,为电解池的阳极,发生失去电子的氧化反应,其电极反应式为2H2O-4e﹣= O2↑+4H+,Ag电极为电解池的阴极,发生得到电子的还原反应,其电极反应式为Cu2++2e﹣═Cu,因此要使CuSO4中溶液恢复到原浓度只需加CuO就可以,C错误;
D.甲池中消耗280mL(标准状况下氧气,其物质的量为0.28/22.4=0.125mol,则转移电子的物质的量为0.0125×4=0.05mol,丙池中阴极的电极反应式为2H2O+2e﹣=H2↑+2OH- ,产生固体的化学方程式为2OH-+Mg2+=Mg(OH)2↓,故产生Mg(OH)2的物质的量为0.05/2=0.025mol,产生固体的质量为0.025×58=1.45g,D正确。
综上所述,本题选D。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
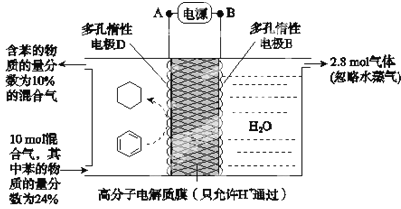
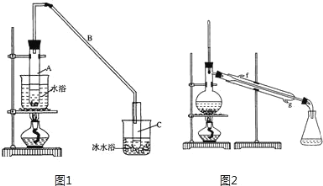
芒果教辅暑假天地重庆出版社系列答案【题目】某化学小组采用如图装置,以环己醇制备环己烯:
已知: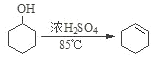 +H2O
+H2O
密度(g/cm3) | 熔点(℃) | 沸点(℃ | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
已知:温度高于100℃时,原料环己醇易和水形成共沸物一起被蒸出反应体系。
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①如图1导管B的作用是______。
②加热试管A采用热水浴,而非直接加热,目的是______,试管C置于冰水浴中的目的是______。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等,加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用______(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液 D.溴水或溴的四氯化碳溶液
②再将环己烯按图2装置蒸馏,冷却水从______口进入(填“上”或“下”)。
③收集产品时,如何判断锥形瓶中收集到的为环己烯。实验制得的环己烯精品质量低于理论产量,可能的原因是______。
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)制环己烯时,由于浓硫酸的强氧化性,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验![]() 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是______(填序号,试剂可重复使用)
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是______(填序号,试剂可重复使用)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液