题目内容
【题目】不同元素的原子吸引电子的能力大小可用一定数值X表示,X值越大,其原子吸引电子的能力越强,在所形成的化合物中为带负电荷的一方。下表是某些元素的X值:
元素符号 |
|
|
|
|
|
|
X值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
元素符号 |
|
|
|
|
|
|
X值 | 0.93 | 1.60 | 1.90 | 2.19 | 2.55 | 3.16 |
(1)通过分析X值的变化规律,确定![]() 、
、![]() 的X值范围:______
的X值范围:______![]() ______;______
______;______![]() ______。
______。
(2)推测X值与原子半径的关系为______。
(3)某有机化合物的结构为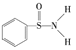 ,其中
,其中![]() 键中,你认为共用电子对偏向______(填元素符号)。
键中,你认为共用电子对偏向______(填元素符号)。
(4)如果X值为电负性的数值,试推断![]() 中化学键的类型为______。
中化学键的类型为______。
(5)预测元素周期表中X值最小的元素(放射性元素除外)是______(填元素符号)。
【答案】0.93 1.57 2.55 3.44 原子半径越大,X值越小 N 共价键 Cs
【解析】
(1)从表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下x值减小,则同周期中x(Na)<x(Mg)<x(Al),同主族中x(Mg)<x(Be),综合可得:0.93<x(Mg)<1.57;同周期中x(C)<x(N)<x(O),可得2.53<x(N)<3.44;
(2)x值在周期表中的递变关系与原子半径的递变关系恰好相反,即:同周期从左到右,随着原子半径依次减小,X值依次增大;同主族从上到下,原子半径越大,X值越小;
(3)对比周期表中对角线位置的x值可知:x(B)>x(Si),x(C)>x(P),x(O)>x(Cl),则可推知:x(N)>x(S),故在S-N中,共有电子对应偏向N;
(4)查表知:AlCl3的△x=156<1.7,又x(Br)<x(Cl),所以AlBr3的△x应小于AlCl3的,因此AlBr3中的化学键为共价键;
(5)根据递变规律,x值最小的应位于第六周期ⅠA族,即为Cs。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】回答下列问题:
(1)基态碳原子的核外电子排布式为______。非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是______(填序号)。
A.甲的金属性比乙强
B.乙有![]() 价
价
C.丙不可能为非金属元素
D.丁一定为金属元素
(3)![]() 、
、![]() 均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 |
|
| |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态![]() 的价电子排布式:______,比较两元素的I2、I3可知,气态
的价电子排布式:______,比较两元素的I2、I3可知,气态![]() 再失去1个电子比气态
再失去1个电子比气态![]() 再失去1个电子难,对此你的解释是______。
再失去1个电子难,对此你的解释是______。
(4)卤族元素![]() 、
、![]() 、
、![]() 、
、![]() 的电负性由小到大的顺序是______。
的电负性由小到大的顺序是______。
(5)基态![]() 原子的电子排布式为______;
原子的电子排布式为______;![]() 和
和![]() 相比,电负性较大的是______;
相比,电负性较大的是______;![]() 中
中![]() 元素的化合价为______。
元素的化合价为______。
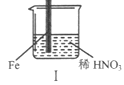
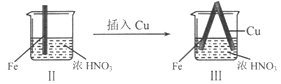
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化