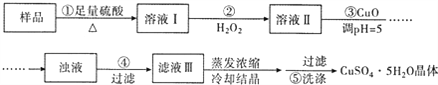
题目内容
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
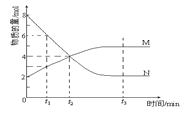
A.反应的化学方程式:2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍
【答案】D
【解析】
A.由图像可知,反应中M的物质的量增减增多,N的物质的量增减减少,则在反应中N为反应物,M为生成物,图像中,在相等的时间内消耗的N和M的物质的量之比为2:1,所以反应方程式为:2NM,A错误;
B.由图像可知t2时,反应没有达到平衡,此时反应继续向正向进行,正反应速率大于逆反应速率,B错误;
C.由图像可知t3时,反应达到平衡,正逆反应速率相等,C错误;
D.t1时N的物质的量为6mol,M的物质的量为3mol,即N的浓度是M浓度的2倍,D正确;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置。
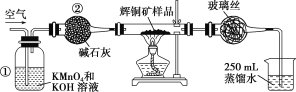
实验原理:Cu2S+O2![]() SO2 +2Cu,通过测定SO2的量来确定Cu2S的质量分数。实验时按如下步骤操作:
SO2 +2Cu,通过测定SO2的量来确定Cu2S的质量分数。实验时按如下步骤操作:
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000 g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1 L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为Cu2S+O2![]() SO2+2Cu。
SO2+2Cu。
F.移取25.00 mL含SO2的水溶液于250 mL锥形瓶中,用0.010 0 mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2~3次。
试回答下列问题:
(1)装置①的作用是______________;装置②的作用是____________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为___。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是____________(写一种即可)。