题目内容
17.短周期A、B、C、D 4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和.(1)元素(写名称):A为碳 B为氧C为钠D为硫
(2)D在周期表中的位置第三周期,第ⅥA族;它的最高价氧化物对应的水化物:H2SO4
(3)C与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑,所得溶液显碱性(“酸性”或“碱性”)
(4)E的电子式为:
 .
.
分析 A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,据此解答.
解答 解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素.
(1)由上述分析可知,A为碳元素、B为氧元素、C为钠元素、D为硫元素,故答案为:碳;氧;钠;硫;
(2)D为S元素,处于第三周期第ⅥA族,S的最高价氧化物的水化物的化学式是H2SO4,故答案为:三;ⅥA;H2SO4;
(3)钠与水反应生成氢氧化钠与氢气,化学反应方程式为:2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠为碱,溶液显碱性,故答案为:2Na+2H2O=2NaOH+H2↑;碱性;
(4)E为Na2O2,电子式为 ,故答案为:
,故答案为: .
.
点评 本题主要考查结构性质位置关系应用,侧重对化学用语的考查,比较基础,注意对基础知识的积累掌握.

练习册系列答案
相关题目
8.下列说法正确的是( )
①非极性分子中一定含有非极性键;
②S-Sσ键与s-pσ键的电子云形状相同;
③含有π键的化合物与只含σ键的化合物的化学性质不同;
④中心原子采取sp3杂化的分子,其立体构型不一定是正四面体
⑤氢键不仅存在于分子之间,有时也存在于分子内
⑥3p2表示3p能级有两个轨道.
①非极性分子中一定含有非极性键;
②S-Sσ键与s-pσ键的电子云形状相同;
③含有π键的化合物与只含σ键的化合物的化学性质不同;
④中心原子采取sp3杂化的分子,其立体构型不一定是正四面体
⑤氢键不仅存在于分子之间,有时也存在于分子内
⑥3p2表示3p能级有两个轨道.
| A. | ③④⑤ | B. | ①②③④⑤ | C. | ②③④ | D. | ②③④⑤⑥ |
9.若某基态原子的外围电子排布为3d34s2,则下列说法正确的是( )
| A. | 该元素基态原子中共有13个电子 | B. | 该元素原子核外有3个电子层 | ||
| C. | 该元素原子最外层共有5个电子 | D. | 该元素原子L能层共有8个电子 |
9.下列化学方程式书写不正确的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SiO2+H2O═H2SiO3 | ||
| C. | Cl2+2NaOH═NaCl+NaClO+H2O | D. | 2H2S+SO2═3S+2H2O |

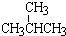 和
和 ; ⑧
; ⑧
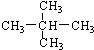 .
. 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.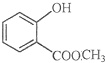 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.