题目内容
KMnO4是一种重要的氧化剂。
(1)①在酸性条件下KMnO4的氧化性会增强。用来酸化KMnO4溶液的最佳试剂是 。
a.硝酸 b.硫酸 c.盐酸
②将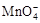 氧化C2O42?的离子方程式补充完整:
氧化C2O42?的离子方程式补充完整:
□MnO4? +□C2O42?+□ ==□Mn2+ +□CO2↑+□ 。
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100 mL 0.0400 mol·L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是 。
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
请分析KMnO4溶液褪色时间变化的可能原因 。
③用配制好的0.040 0 mol·L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度。每次准确量取25.00 mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定。滴定三次分别消耗的KMnO4溶液的体积是20.00 mL、19.80 mL、20.20 mL,则KMnO4溶液的浓度为 。
(1)①在酸性条件下KMnO4的氧化性会增强。用来酸化KMnO4溶液的最佳试剂是 。
a.硝酸 b.硫酸 c.盐酸
②将
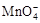 氧化C2O42?的离子方程式补充完整:
氧化C2O42?的离子方程式补充完整:□MnO4? +□C2O42?+□ ==□Mn2+ +□CO2↑+□ 。
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100 mL 0.0400 mol·L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是 。
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60 s |
| 褪色后,再滴入第2滴 | 15 s |
| 褪色后,再滴入第3滴 | 3 s |
| 褪色后,再滴入第4滴 | 1 s |
请分析KMnO4溶液褪色时间变化的可能原因 。
③用配制好的0.040 0 mol·L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度。每次准确量取25.00 mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定。滴定三次分别消耗的KMnO4溶液的体积是20.00 mL、19.80 mL、20.20 mL,则KMnO4溶液的浓度为 。
(1)①b ②2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
(2)①容量瓶、胶头滴管;
②反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好;③0.02mol/L
(2)①容量瓶、胶头滴管;
②反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好;③0.02mol/L
试题分析:(1)①在酸性条件下,高锰酸钾与NO3-、Cl-能发生氧化还原反应,不与SO42-反应,故b正确;②根据缺项配平法,方程式左边氧原子个数多于右边氧原子的个数,左边方格内加氢,右边方格内加H2O,根据得失电子守恒可知:高锰酸钾中的锰离子由+7价降为+2价,共得到5mol电子,草酸钠中碳元素的化合价由+3价升为+4价,共失去2mol电子,要使得失电子守恒,消耗的草酸钠与高锰酸钾的物质的量之比应为5:2,即化学方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
(2)①对于未知仪器的选择最好的办法就是要按照化学实验的步骤去核对,才不会疏漏,配置一定物质的量浓度的溶液需要容量瓶、胶头滴管;②反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好,故答案为:反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好。
③KMnO4溶液的体积取三次测量的平均值为:
 =20.00ml,设高锰酸钾溶液的浓度为c
=20.00ml,设高锰酸钾溶液的浓度为c2MnO4-+5C2O42- +16H+=2Mn2+ +10CO2↑+8H2O
2mol 5mol
c×(20×10-3) L (25×10-3)L× 0.0400 mol·L-1
所以2mol:5mol= c×(20×10-3) :(25×10-3) × 0.0400
解得c=0.02mol/L 故答案为:0.02mol/L.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



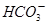 完全转化为CaCO3
完全转化为CaCO3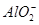 形式存在
形式存在 ,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作: 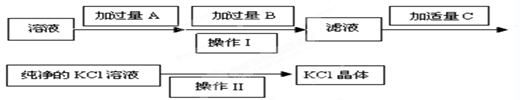
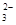 、OH-、HCO
、OH-、HCO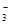 、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作: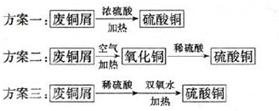
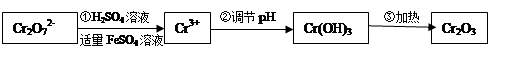
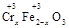 ·y
·y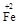 O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
