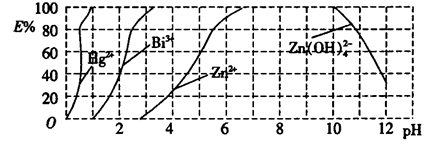
题目内容
在学习了铜元素的性质之后,小明同学做了H2O2与铜的有关探究实验:
实验一:将铜丝置于装有H2O2溶液的试管中,没有气体产生;加热溶液时,观察到铜丝表面产生大量气体。
实验二:将铜丝置于装有硫酸酸化的H2O2溶液的试管中,溶液迅速变蓝。同时产生大量气体。
请回答下列问题:
(1)上述实验一(加热时)、实验二中铜丝表面均产生了大量气体,该气体是 。
(2)写出在酸性条件下H2O2氧化铜丝的离子方程式: 。
(3)H2O2能发生多种化学反应,等物质的量的H2O2在仅作氧化剂的反应、仅作还原剂的反应和分解反应中转移的电子数目之比为 。
小明同学设计了以废铜屑制取硫酸铜的三个方案:
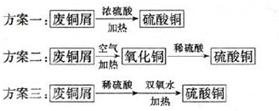
①认为最佳方案是 。
②简述另两个方案的不足之处: 。
实验一:将铜丝置于装有H2O2溶液的试管中,没有气体产生;加热溶液时,观察到铜丝表面产生大量气体。
实验二:将铜丝置于装有硫酸酸化的H2O2溶液的试管中,溶液迅速变蓝。同时产生大量气体。
请回答下列问题:
(1)上述实验一(加热时)、实验二中铜丝表面均产生了大量气体,该气体是 。
(2)写出在酸性条件下H2O2氧化铜丝的离子方程式: 。
(3)H2O2能发生多种化学反应,等物质的量的H2O2在仅作氧化剂的反应、仅作还原剂的反应和分解反应中转移的电子数目之比为 。
小明同学设计了以废铜屑制取硫酸铜的三个方案:

①认为最佳方案是 。
②简述另两个方案的不足之处: 。
(1)O2(2分)
(2)H2O2+2H++Cu=Cu2++2H2O(2分)
(3)2∶2∶1(2分)
(4)①方案二(1分)
②方案一生成的二氧化硫污染环境的同时会消耗更多的硫酸,方案三铜会催化过氧化氢的分解,增大成本(2分)
(2)H2O2+2H++Cu=Cu2++2H2O(2分)
(3)2∶2∶1(2分)
(4)①方案二(1分)
②方案一生成的二氧化硫污染环境的同时会消耗更多的硫酸,方案三铜会催化过氧化氢的分解,增大成本(2分)
试题分析:(1)结合题意分析可知为:O2。
(2)H2O2+2H++Cu=Cu2++2H2O
(3)H2O2在仅作氧化剂的反应中-1价氧转变为-2价氧的得2电子、仅作还原剂的反应-1价氧转变为0价氧失去2电子,分解反应中-1价氧转移的1电子,等物质的量H2O2转移的数目之比为2∶2∶1。
(4)方案一生成的二氧化硫污染环境的同时会消耗更多的硫酸,方案三铜会催化过氧化氢的分解,增大成本,所以选择方案二。

练习册系列答案
相关题目
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
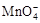 氧化C2O42?的离子方程式补充完整:
氧化C2O42?的离子方程式补充完整:
 Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。