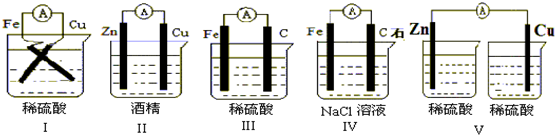
题目内容
13.大容量Li-SO2电池有内阻小、放电功率高、能量大和低温性能好等特点.其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池总反应式为:2Li+2SO2$?_{充电}^{放电}$Li2S2O4.下列说法不正确的是( )| A. | 放电时,负极反应式为Li-e-═Li+ | |
| B. | 充电时,阳极反应式为S2O42--2e-═2SO2 | |
| C. | 放电时Li+向负极移动 | |
| D. | 该电池的溶液不使用水溶液,原因是Li易与水反应 |
分析 根据电池反应式知,放电时,Li是负极,负极反应式为Li-e-═Li+,正极反应式为2SO2+2e-=S2O42-;充电时,阴极、阳极反应式与负极、正极反应式正好相反,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答 解:A.根据电池反应式知,放电时,Li是负极,负极反应式为Li-e-═Li+,故A正确;
B.充电时,阳极上失电子发生氧化反应,电极反应式为S2O42--2e-═2SO2,故B正确;
C.放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,所以Li+向正极移动,故C错误;
D.Li性质较活泼,能和水反应生成LiOH和氢气,所以不能用水溶液作电解质溶液,故D正确;
故选C.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应及离子移动方向即可解答,难点是电极反应式的书写,题目难度不大.

练习册系列答案
相关题目
3.下列化学变化中,不能够通过一步反应实现的是( )
| A. | Na→Na2O2 | B. | N2→NH3 | C. | N2→NO2 | D. | Ca(OH)2→NaOH |
1.NA为阿伏加德罗常数,下述正确的是( )
| A. | 58.5g氯化钠晶体中含有NA个氯化钠分子 | |
| B. | 20g重水(D2O)中含有的电子数为10NA | |
| C. | 标准状况下,22.4L CCI4含有NA个CCI4分子 | |
| D. | 120g NaHSO4晶体中阳离子和阴离子的总数为3NA |
8.燃煤烟气中含有大量的氮氧化合物(NOx),不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.
Ⅰ.CH4还原法:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=akJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=bkJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=$\frac{a+b}{2}$kJ/mol.
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=akJ•mol-1
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
(1)在0~10min内化学反应速率υNO2(T1):υNO2(T2)为3:4;
(2)T1<T2(填<、=、>),a<(填<、=、>)0;
(3)在T1时,0~10min内内NO2的转化率是50%,欲提高NO2的转化率同时加快反应速率,可采取的措施有B.
A.缩小容器体积 B.增大CH4浓度 C.降低温度 D.加入催化剂
Ⅱ. NOx也可以用NH3还原除去,利用反应:6NO2+8NH3$?_{加热}^{催化剂}$7N2+12H2O也可处理NO2.当氧化产物和还原产物的质量差为14g时,转移电子的物质的量为12mol.
Ⅰ.CH4还原法:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=akJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=bkJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=$\frac{a+b}{2}$kJ/mol.
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=akJ•mol-1
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
| 温度 | n/mol时间/min | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
(2)T1<T2(填<、=、>),a<(填<、=、>)0;
(3)在T1时,0~10min内内NO2的转化率是50%,欲提高NO2的转化率同时加快反应速率,可采取的措施有B.
A.缩小容器体积 B.增大CH4浓度 C.降低温度 D.加入催化剂
Ⅱ. NOx也可以用NH3还原除去,利用反应:6NO2+8NH3$?_{加热}^{催化剂}$7N2+12H2O也可处理NO2.当氧化产物和还原产物的质量差为14g时,转移电子的物质的量为12mol.
18.水的作用与反应Br2+SO2+2H2O═H2SO4+2HBr不相同的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | Cl2+H2O═HCl+HClO | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
2.关于钠和水的反应,下列说法正确的是( )
| A. | 水既不显酸性又不显碱性 | |
| B. | 水既是氧化剂又是还原剂 | |
| C. | 钠既容易被氧化又容易被还原 | |
| D. | 该反应既是置换反应又是氧化还原反应 |
8. 苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理和实验主要装置甲如下:
苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理和实验主要装置甲如下:

已知:①甲苯为无色澄清液体,微溶于水,沸点110.6℃.
②苯甲酸的熔点为122.4℃.
③苯甲酸在25C和95°C时的溶解度分别为0.17g和6.8g.
实验流程:
I、往甲装置中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加人8.5g稍过量的
KMn04固体,控制反应温度约在1000C,回流反应4小时.
Ⅱ、将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加人浓盐
酸,经操作B得白色较干燥粗产品.
Ⅲ、纯度测定:称取1.220g白色样品,配成l00mL苯甲酸溶液,取25.00mL溶液,用0.1000mol•L-1
KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示:
请回答:
(1)仪器A的名称(球形)冷凝管,图甲冷水应从a(填“a“或“b“)管进人.
(2)判断甲苯被氧化完全的实验现象是甲苯层消失,回流液不再有明显的油珠
(3)根据实验过程B,回答下列两个问题:
①操作B的名称过滤
②如果滤液呈紫色,要先加亚硫酸氢钾,然后再加人浓盐酸酸化,加亚硫酸氢钾的目的是将过量的KMnO4反应掉,防止其与浓盐酸反应
(4)实验所得的苯甲酸在结晶过程中常裹携KC1析出.
①结合题中所给苯甲酸的性质,设计检验苯甲酸固体中KC1的实验方案:取适量样品加热水溶解后,冷却过滤得滤液(或取上层清液),向滤液中滴加硝酸酸化的硝酸银溶液,若得到白色沉淀,则可证明样品中含有KCl
②除去产品中KCl的实验方法的名称是重结晶
(5)样品中苯甲酸纯度为96.00%.
 苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理和实验主要装置甲如下:
苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理和实验主要装置甲如下:
已知:①甲苯为无色澄清液体,微溶于水,沸点110.6℃.
②苯甲酸的熔点为122.4℃.
③苯甲酸在25C和95°C时的溶解度分别为0.17g和6.8g.
实验流程:
I、往甲装置中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加人8.5g稍过量的
KMn04固体,控制反应温度约在1000C,回流反应4小时.
Ⅱ、将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加人浓盐
酸,经操作B得白色较干燥粗产品.
Ⅲ、纯度测定:称取1.220g白色样品,配成l00mL苯甲酸溶液,取25.00mL溶液,用0.1000mol•L-1
KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(1)仪器A的名称(球形)冷凝管,图甲冷水应从a(填“a“或“b“)管进人.
(2)判断甲苯被氧化完全的实验现象是甲苯层消失,回流液不再有明显的油珠
(3)根据实验过程B,回答下列两个问题:
①操作B的名称过滤
②如果滤液呈紫色,要先加亚硫酸氢钾,然后再加人浓盐酸酸化,加亚硫酸氢钾的目的是将过量的KMnO4反应掉,防止其与浓盐酸反应
(4)实验所得的苯甲酸在结晶过程中常裹携KC1析出.
①结合题中所给苯甲酸的性质,设计检验苯甲酸固体中KC1的实验方案:取适量样品加热水溶解后,冷却过滤得滤液(或取上层清液),向滤液中滴加硝酸酸化的硝酸银溶液,若得到白色沉淀,则可证明样品中含有KCl
②除去产品中KCl的实验方法的名称是重结晶
(5)样品中苯甲酸纯度为96.00%.
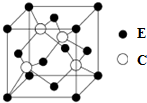 A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题:
A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题: