题目内容
4. A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题:
A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题:(1)D原子的核外电子排布式为1s22s22p63s23p5,E的价电子排布为3d104s2.
(2)单质B有两种同素异形体,其中沸点高的是O3(填分子式),原因是O3相对原子质量较大,范德华力较大;
(3)A、B、C中第一电离能最大的是N(填元素符号),其中A的氢化物(AH3)分子中,A原子轨道的杂化类型是sp3.
(4)化合物D2B的立体构型为V形,单质D与湿润的Na2CO3反应可制备D2B,其化学方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl.
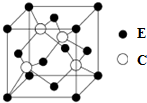
(5)E与C所形成化合物晶体的晶胞如右图所示.
①在1个晶胞中,E离子的数目为4.
②该化合物的化学式为ZnS.
分析 A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,价电子排布为2s22p3,则A为N元素;B的最外层电子数为其内层电子数的3倍,则B的最外层电子数为6,B为O元素;C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,则C的原子序数为16,即C为S元素;D元素最外层有一个未成对电子,D为Cl元素;E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,即电子排布为[Ar]3d104s2,为Zn元素,以此来解答.
解答 解:A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,价电子排布为2s22p3,则A为N元素;B的最外层电子数为其内层电子数的3倍,则B的最外层电子数为6,B为O元素;C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,则C的原子序数为16,即C为S元素;D元素最外层有一个未成对电子,D为Cl元素;E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,即电子排布为[Ar]3d104s2,为Zn元素,
(1)D原子序数为17,其核外电子排布式为1s22s22p63s23p5,E的价电子排布式为3d104s2,故答案为:1s22s22p63s23p5;3d104s2;
(2)两种单质为氧气和臭氧,O3相对原子质量较大,范德华力较大,则沸点高,故答案为:O3;O3相对原子质量较大,范德华力较大;
(3)非金属性强,第一电离能大,但N原子2 2p电子半满为稳定状态,其第一电离能最大,则A、B、C中第一电离能最大的是N,A的氢化物(AH3)分子为三角锥型,A原子轨道的杂化类型是sp3,故答案为:N;sp3;
(4)化合物Cl2O与水的结构相似,O为sp3杂化,且存在两对孤对电子,其立体构型为V形,单质D与湿润的Na2CO3反应可制备D2B,其化学方程式为2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,
故答案为:V形; 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl;
(5)①由图可知,E离子位于顶点和面心,其数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案为:4;
②由图可知,C位于体内,个数为4,E、C的个数比为1:1,其化学式为ZnS,故答案为:ZnS.
点评 本题考查晶胞计算及位置、结构与性质,为高频考点,把握元素的电子排布推断元素为解答的关键,侧重分析、推断及计算能力的考查,题目难度中等.

| A. | 2Na218O2+2H2O═4Nal8OH+O2↑ | |
| B. | NH4Cl+2H2O═NH3•2H2O+HCl | |
| C. | 2KMnO4+5H218O2+3H2SO4═K2SO4+2MnSO4+518O2↑+8H2O | |
| D. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
| 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | |
| 分子式 | CH4 | C2H6 | C3H8 | C4H10 | C5H12 |
结构式 | 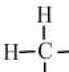 | 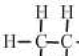 | 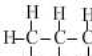 |  | 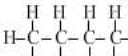 |
| A. | 3:7 | B. | 44:21 | C. | 6:7 | D. | 11:12 |
| A | B | C | D |
 | 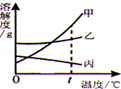 | 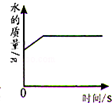 | 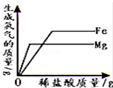 |
| 常温下,向一定量的饱和石灰水中加入氧化钙 | t℃时,向等质量的甲、乙、丙三种物质中分别加水配成饱和溶液,所得溶液质量最小的是丙 | 向一定质量的过氧化氢的水溶液中加入二氧化锰 | 向等质量的铁和镁中分别加入足量的稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | C2H6 | B. | C4H10 | C. | C5H12 | D. | C6H6 |
| A. | 放电时,负极反应式为Li-e-═Li+ | |
| B. | 充电时,阳极反应式为S2O42--2e-═2SO2 | |
| C. | 放电时Li+向负极移动 | |
| D. | 该电池的溶液不使用水溶液,原因是Li易与水反应 |