题目内容
2.关于钠和水的反应,下列说法正确的是( )| A. | 水既不显酸性又不显碱性 | |
| B. | 水既是氧化剂又是还原剂 | |
| C. | 钠既容易被氧化又容易被还原 | |
| D. | 该反应既是置换反应又是氧化还原反应 |
分析 钠和水反应方程式为2Na+2H2O=2NaOH+H2↑,该反应中Na元素化合价由0价变为+1价、H元素化合价由+1价变为0价,钠完全反应后溶液中的溶质为NaOH,
A.根据溶液中的溶质确定溶液酸碱性;
B.有电子转移的化学反应是氧化还原反应,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂;
C.根据钠原子结构确定钠性质;
D.有电子转移的化学反应是氧化还原反应,一种单质和一种化合物反应生成另外的单质和化合物的反应是置换反应.
解答 解:钠和水反应方程式为2Na+2H2O=2NaOH+H2↑,该反应中Na元素化合价由0价变为+1价、H元素化合价由+1价变为0价,钠完全反应后溶液中的溶质为NaOH,
A.溶液中的溶质是NaOH,所以反应后溶液呈碱性,故A错误;
B.该反应中钠是还原剂、水是氧化剂,故B错误;
C.钠原子最外层只有一个电子,易失电子被氧化,故C错误;
D.该反应中有电子转移,所以属于氧化还原反应;为一种化合物和一种单质反应生成另外的单质和化合物的反应,属于置换反应,故D正确;
故选D.
点评 本题以钠和水的反应为载体考查基本概念及基本理论,为高频考点,明确氧化还原反应实质及基本概念即可解答,题目难度不大.

练习册系列答案
相关题目
12.一类有机化合物可以根据分子里所含碳原子数命名,碳原子数在十以下的,用天干来表示,即甲、乙、丙、丁、戊、己、庚、辛、壬、癸.下面是部分有机物分子组成和结构,据此推测己烷完全燃烧产生二氧化碳和水的质量比为( )
| 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | |
| 分子式 | CH4 | C2H6 | C3H8 | C4H10 | C5H12 |
结构式 | 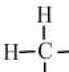 | 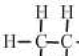 | 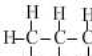 |  | 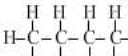 |
| A. | 3:7 | B. | 44:21 | C. | 6:7 | D. | 11:12 |
13.大容量Li-SO2电池有内阻小、放电功率高、能量大和低温性能好等特点.其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池总反应式为:2Li+2SO2$?_{充电}^{放电}$Li2S2O4.下列说法不正确的是( )
| A. | 放电时,负极反应式为Li-e-═Li+ | |
| B. | 充电时,阳极反应式为S2O42--2e-═2SO2 | |
| C. | 放电时Li+向负极移动 | |
| D. | 该电池的溶液不使用水溶液,原因是Li易与水反应 |
10.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 室温下,向NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| B. | 0.1mol•L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| C. | NaHSO3溶液:c(OH-)+c(SO32-)=c(HSO3-)+2c(H2SO3)+c(H+) | |
| D. | 25℃时,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液,pH=4.75:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
17.下列关于物质的检验方法正确的是( )
| A. | 用硫酸铜溶液鉴别氢氧化钠和碳酸钠溶液 | |
| B. | 用紫色石蕊试液测定雨水的酸碱度 | |
| C. | 往固体中加入稀盐酸,出现气泡说明该固体一定是碳酸盐 | |
| D. | 只用酚酞试液就能将氯化钠溶液、氢氧化钠溶液、盐酸区别开来 |
7.“垃圾是放错了地方的资源”,应分类回收利用.生活中废弃的铁锅、铝制易拉罐、铜导线、废旧电池的锌皮等属于( )
| A. | 氧化物 | B. | 有机物 | C. | 金属或合金 | D. | 酸、碱、盐 |
11.下列实验操作中,不是主要从安全因素考虑的是( )
| A. | 给试管里的固体加热时,试管口应略向下倾斜,外壁干燥后再预热 | |
| B. | 给试管里的液体加热时.试管口应略向上倾斜(约45°),外壁干燥后再预热 | |
| C. | 加热后的蒸发皿,要用坩埚钳夹持 | |
| D. | 盛装浓硫酸的铁桶,用水冲洗,并用打火机照明 |

 ,甲的化学式Na2S2O4
,甲的化学式Na2S2O4