题目内容
1.NA为阿伏加德罗常数,下述正确的是( )| A. | 58.5g氯化钠晶体中含有NA个氯化钠分子 | |
| B. | 20g重水(D2O)中含有的电子数为10NA | |
| C. | 标准状况下,22.4L CCI4含有NA个CCI4分子 | |
| D. | 120g NaHSO4晶体中阳离子和阴离子的总数为3NA |
分析 A、氯化钠是离子晶体;
B、求出重水的物质的量,然后根据1mol重水中含10mol电子来分析;
C、标况下,四氯化碳为液态;
D、求出NaHSO4的物质的量,然后根据1molNaHSO4中含1mol钠离子和1molHSO4-构成来分析.
解答 解:A、氯化钠是离子晶体,无氯化钠分子,故A错误;
B、重水的摩尔质量为20g/mol,故20g重水的物质的量为1mol,而1mol重水中含10mol电子即10NA个,故B正确;
C、标况下,四氯化碳为液态,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、120gNaHSO4的物质的量n=$\frac{120g}{120g/mol}$=1mol,而1molNaHSO4中含1mol钠离子和1molHSO4-,故含2mol离子即2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
11.下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
| 选项 | 离子组 | 所加试剂 | 离子方程式 |
| A | Mg2+、Fe3+、NO3- | KSCN溶液 | Fe3++3SCN-═Fe(SCN)3↓ |
| B | NH4+、HCO3-、Cl- | 过量NaOH溶液 | HCO3-+OH-═CO32-+H2O |
| C | Fe2+、Cl-、H+ | KNO3溶液 | 3Fe2++NO3-+4H+═NO↑+2H2O+3Fe3+ |
| D | K+、H+、C6H5O- | Na2CO3溶液 | 2H++CO32-═CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
12.一类有机化合物可以根据分子里所含碳原子数命名,碳原子数在十以下的,用天干来表示,即甲、乙、丙、丁、戊、己、庚、辛、壬、癸.下面是部分有机物分子组成和结构,据此推测己烷完全燃烧产生二氧化碳和水的质量比为( )
| 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | |
| 分子式 | CH4 | C2H6 | C3H8 | C4H10 | C5H12 |
结构式 | 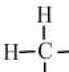 | 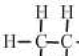 | 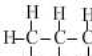 |  | 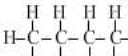 |
| A. | 3:7 | B. | 44:21 | C. | 6:7 | D. | 11:12 |
16.某种烃或其一种同分异构体的一氯代物只有一种结构,则该烃的分子式不可能是( )
| A. | C2H6 | B. | C4H10 | C. | C5H12 | D. | C6H6 |
13.大容量Li-SO2电池有内阻小、放电功率高、能量大和低温性能好等特点.其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池总反应式为:2Li+2SO2$?_{充电}^{放电}$Li2S2O4.下列说法不正确的是( )
| A. | 放电时,负极反应式为Li-e-═Li+ | |
| B. | 充电时,阳极反应式为S2O42--2e-═2SO2 | |
| C. | 放电时Li+向负极移动 | |
| D. | 该电池的溶液不使用水溶液,原因是Li易与水反应 |
10.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 室温下,向NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| B. | 0.1mol•L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| C. | NaHSO3溶液:c(OH-)+c(SO32-)=c(HSO3-)+2c(H2SO3)+c(H+) | |
| D. | 25℃时,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液,pH=4.75:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
11.下列实验操作中,不是主要从安全因素考虑的是( )
| A. | 给试管里的固体加热时,试管口应略向下倾斜,外壁干燥后再预热 | |
| B. | 给试管里的液体加热时.试管口应略向上倾斜(约45°),外壁干燥后再预热 | |
| C. | 加热后的蒸发皿,要用坩埚钳夹持 | |
| D. | 盛装浓硫酸的铁桶,用水冲洗,并用打火机照明 |