题目内容
17.下列有关实验的叙述正确的是( )| A. | 除去(NH4)2CO3溶液中含有的少量NH4HCO3杂质的方法是加入NaOH溶液 | |
| B. | 将混有HCl的Cl2通入饱和NaHCO3溶液中不能得到纯净的氯气 | |
| C. | 向两份Fe2O3的固体中分别加入HCl溶液与HI溶液,二者反应现象相同 | |
| D. | 向固体中加入足量的浓HNO3加热,能得到使澄清石灰水变浑浊的气体,证明该固体中一定存在CO32-或HCO3- |
分析 A.加入NaOH溶液,引入新杂质;
B.生成二氧化碳气体;
C.加入HI,生成具有强氧化性的Fe3+;
D.固体中不存在自由移动的离子.
解答 解:A.加入NaOH溶液,可生成碳酸钠,引入新杂质,且二者都与氢氧化钠反应,应用适量氨水除杂,故A错误;
B.将混有HCl的Cl2通入饱和NaHCO3溶液中生成二氧化碳气体,不能得到纯净的氯气,应用饱和食盐水,故B正确;
C.加入HI,生成具有强氧化性的Fe3+,可生成碘,现象不同,故C错误;
D.固体中不存在自由移动的离子,可证明固体为碳酸盐或碳酸氢盐,故D错误.
故选B.
点评 本题考查较为综合,涉及物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同以及实验的严密性的评价,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列关于化学反应速率的说法中正确的是( )
| A. | 化学反应速率可用某时刻生成物的物质的量来表示 | |
| B. | 在同一反应中,用反应物或生成物表示的化学反应速率的值是相对的 | |
| C. | 化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加 | |
| D. | 可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠和硫酸的反应速率 |
12.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | CO和 N2为等电子体,22.4L的CO气体和1mol N2所含的电子数相等 | |
| B. | 1L密度为1.84g•cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA | |
| C. | 在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA | |
| D. | 在标准状况下,30g福尔马林和22.4L三氧化硫所含氧原子数之比为1:3 |
2.下列物质一定属于同系物的是( )
①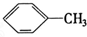 ②
②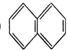 ③
③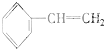 ④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦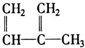 ⑧
⑧
①
 ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦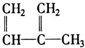 ⑧
⑧
| A. | ⑦和⑧ | B. | ⑤和⑦ | C. | ①、②和③ | D. | ④、⑥和⑧ |
6.下列单体中在一定条件下发生加聚反应生成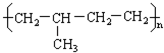 的是( )
的是( )
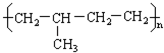 的是( )
的是( )| A. | CH2=CH2和CH4 | B. |  | ||
| C. | CH3-CH=CH2和CH2=CH2 | D. | 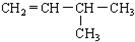 |
 图1
图1
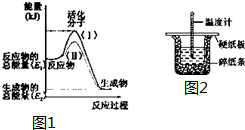 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图1,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察如图1,然后回答问题.