题目内容
14.质子交换膜燃料电池广受关注.(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气.
已知:C(s)+O2(g)═CO(g)△H1=-110.35kJ•mol-1
2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJ•mol-1
H2O(l)═H2O(g)△H3=+44.0kJ•mol-1
则C(s)+H2O(g)═CO(g)+H2(g)△H4=+131.45kJ/mol.
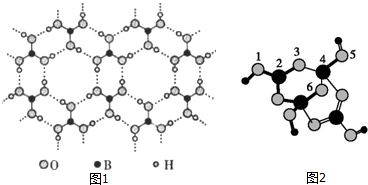
(2)燃料气(流速为1800mL•h-1;体积分数为50% H2,0.98% CO,1.64% O2,47.38% N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除.
①160℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为2CO+O2$\frac{\underline{\;CuO/CeO_{2}\;}}{160℃}$2CO2.
②灼烧草酸铈[Ce2(C2O4)3]制得CeO2的化学方程式为Ce2(C2O4)3$\frac{\underline{\;高温\;}}{\;}$2CeO2+4CO↑+2CO2↑.
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图1所示,加入HIO3(填酸的化学式)的CuO/CeO2催化剂催化性能最好.催化剂为$\frac{CuO}{Ce{O}_{2}}$-HIO3,120℃时,反应1h后CO的体积为3.528mL.
(3)图2为甲酸质子交换膜燃料电池的结构示意图.该装置中a(填“a”或“b”)为电池的负极,负极的电极反应式为HCOOH-2e-=CO2+2H+
分析 (1)根据盖斯定律来计算化学反应的焓变;
(2)①160℃、CuO/CeO2作催化剂时,CO优先氧化为二氧化碳;
②灼烧草酸铈[Ce2(C2O4)3],分解制得CeO2、一氧化碳以及二氧化碳,配平方程式即可;
③CuO/CeO2催化剂催化性能最好,即化学反应速率最快,据图象来回答;催化剂为CuO/CeO2-HIO3,120℃时,CO的转化率是80%来计算回答;
(3)在燃料点池中,氢离子移向正极,在负极上发生燃料失电子的氧化反应.
解答 解:(1)已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.35kJ•mol-1
②2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJ•mol-1
③H2O(l)═H2O(g)△H3=+44.0kJ•mol-1
则:反应C(s)+H2O(g)═CO(g)+H2(g)可以是①+②×$\frac{1}{2}$-③得到,所以△H4=①+②×$\frac{1}{2}$-③=(-110.35kJ•mol-1)+(571.6kJ•mol-1)×$\frac{1}{2}$-44.0kJ•mol-1
=+131.45kJ/mol,故答案为:+131.45kJ/mol;
(2)①160℃、CuO/CeO2作催化剂时,CO优先氧化为二氧化碳,方程式为:2CO+O2$\frac{\underline{\;CuO/CeO_{2}\;}}{160℃}$2CO2,故答案为:2CO+O2$\frac{\underline{\;CuO/CeO_{2}\;}}{160℃}$2CO2;
②灼烧草酸铈[Ce2(C2O4)3],分解制得CeO2、一氧化碳以及二氧化碳,即 Ce2(C2O4)3$\frac{\underline{\;高温\;}}{\;}$2CeO2+4CO↑+2CO2↑,故答案为:Ce2(C2O4)3$\frac{\underline{\;高温\;}}{\;}$2CeO2+4CO↑+2CO2↑;
③CuO/CeO2催化剂催化性能最好,即化学反应速率最快,据图象知道当HIO3加入时,催化性能最好,催化剂为CuO/CeO2-,120℃时,CO的转化率是80%,气体混合物流速为1800mL•h-1;体积分数为:0.98%的CO,则反应1小时后CO的体积为$\frac{1}{4}$×1800×1×0.98%×80%=3.528,故答案为:HIO3;3.528;
(3)在燃料点池中,氢离子移向正极b极,所以a是负极,在负极上发生燃料失电子的氧化反应:HCOOH-2e-=CO2+2H+,故答案为:a;HCOOH-2e-=CO2+2H+.
点评 本题目综合考查学生电化学、热化学、盖斯定律的应用等综合知识,注意知识的归纳和整理是关键,难度中等.

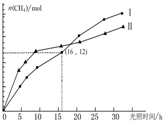 将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:
将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H=+802kJ•mol-1如图为在恒温、光照和不同催化剂(Ⅰ、Ⅱ)作用下,体积为1L的密闭容器中n (CH4)随光照时间的变化曲线.下列说法正确的是( )
| A. | 0~25h内,催化剂Ⅰ的催化效果比催化剂Ⅱ的效果好 | |
| B. | 0~16h内,v(H2O)Ⅰ=1.5 mol/(L•h) | |
| C. | 在两种不同催化剂下,该反应的平衡常数不相等 | |
| D. | 反应开始后的15h内,第Ⅰ种催化剂的作用下,得到的CH4最多 |
| A. | 容器内总压强不再变化 | B. | 混合气体的密度不再变化 | ||
| C. | 混合气体的平均摩尔质量不再变化 | D. | 混合气体的总质量不再变化 |
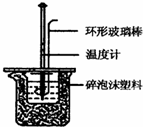 某同学在实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
某同学在实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)实验时用环形玻璃棒搅拌溶液的方法是上下搅动不能用铜丝搅.拌棒代替环形玻璃棒的理由是铜传热快,防止热量损失.同时为保证实验成功该同学采取了许多措施,如图碎泡沫塑料的作用为隔热,减少热量的损失.
(2)经数据处理,t2-t1=3.4℃盐酸和NaOH溶液的密度按1g•cm-3计算,反应后,混合溶液的比热容按4.18J•g-1•℃-1计算).则该实验测得的中和热△H=-56.8kJ/mol
(3)若将盐酸改为浓硫酸,测得中和热为△H1,则△H1与△H的关系为:△H1<△H (填“<”、“>”或“=”).
(4)倒入NaOH溶液的正确操作是C(填字母).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)上述实验数值结果与57.3kJ mol-1有偏差,产生偏差的原因可能是abc(填字母).
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定酸溶液的温度
c.分多次把NaOH溶液倒人盛有硫酸的小烧杯中.
I.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,在一定条件下与H2反应,使之变为可再生燃料甲醇.其流程如图1:
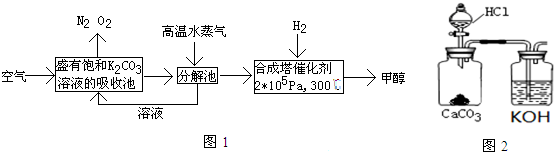
①上述流程中碳酸钾溶液所起的作用是吸收或富集二氧化碳.
②在分解池中发生的反应为2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+CO2↑+H2O(写出化学方程式).
Ⅱ.碳酸钾是重要的无机化工、医药、轻工原料之一,主要用于医药、玻璃、染料等工业,可用作气体吸附剂,干粉灭火剂,橡胶防老剂等.
已知:CO2、碳酸盐、碳酸氢盐的部分性质如下:CO2(过量)+OH-═HCO3- HCO3-+OH-═CO32-+H2O
CO32-与H+反应生成CO2分两步:CO32-+H+═HCO3-;HCO3-+H+═H2O+CO2↑
①小王同学在实验室用如图2所示的装置和药品制取K2CO3溶液.他所制得的溶液中可能含有的杂质是碳酸氢钾氯化钾或氢氧化钾和氯化钾.
②该同学在数字实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成稀溶液,然后分别逐滴加入相同浓度的50ml硫酸,测得如表数据:
| 实验编号 | 1 | 2 | 3 |
| 混合物的质量/g | 3.76 | 4.70 | 8.46 |
| 硫酸溶液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量/mol | 0.03 | 0.0375 | 0.03 |

 .
.