题目内容
【题目】密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i.CO(g)+2H2(g) ![]() CH3OH(g) H1=90.1kJ·mol1
CH3OH(g) H1=90.1kJ·mol1
ii.2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如右图所示。下列说法正确的是( )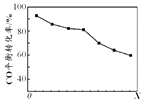
A.由H2和CO直接制备二甲醚的反应为放热反应
B.条件X为压强
C.X增大,二甲醚的产率一定增大
D.X增大,该反应的平衡常数一定减小
【答案】A
【解析】A . 将i×2+ ii得:2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) H= 204.7 kJ·mol1,因此由H2和CO直接制备二甲醚的反应为放热反应,故A符合题意;
CH3OCH3(g) + H2O(g) H= 204.7 kJ·mol1,因此由H2和CO直接制备二甲醚的反应为放热反应,故A符合题意;
B. 根据,2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g),压强越大,CO平衡转化率越大,与图像不符,故B不符合题意;
CH3OCH3(g) + H2O(g),压强越大,CO平衡转化率越大,与图像不符,故B不符合题意;
C. X增大,CO平衡转化率减小,二甲醚的产率可能减小,故C不符合题意;
D. 根据图像,X可能是温度,温度升高,平衡逆向移动,反应的平衡常数减小,X也可能是减小压强,平衡逆向移动,CO平衡转化率减小,但平衡常数不变,故D不符合题意。
所以答案是:A
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 一线名师提优试卷系列答案
一线名师提优试卷系列答案