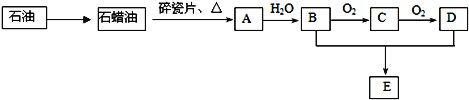
��Ŀ����
����Ŀ���ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe��ˮ�����ɷ�����Ӧ��Ӧ������װ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ����¡�Fe��ˮ�����ķ�Ӧʵ�顱�� ��ش��ʵ���е����⡣
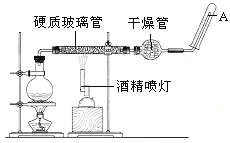
��1��д���÷�Ӧ�Ļ�ѧ����ʽ__________________________________________��
��2����������ʯ����������__________________________________��Բ����ƿ��ʢװˮ����ƿ��Ӧ���ȷ���_________________����������______________��
��3����ͬѧ��ȷ����Ӧ��Ӳ���Թ��й������ʵijɷ֣����������ʵ�鷽����
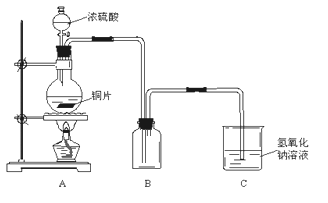
�ٴ�Ӳ���Թ���ȴ��ȡ�������еĹ�����������ϡ�������ҺB��
��ȡ������ҺB�μ�KSCN��Һ������Һ���ɫ��˵��Ӳ���Թ��й������ʵijɷ���_______________________������Һδ���ɫ��˵��Ӳ���Թ��й������ʵijɷ���_______________________��
��4����ͬѧ������ʵ�鷽��������ʵ�飬�����Һδ���ɫ��ԭ����___________________�������ӷ���ʽ��ʾ����
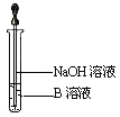
��5����ͬѧ������ȡ������ҺB��ʹ���NaOH��Һ��Ӧ������ͼ��ʾ�IJ������ɹ۲쵽���ɰ�ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��������д��������������صķ�Ӧ�Ļ�ѧ����ʽ_____________________________ ��________________________��
��6��һ��ʱ���ͬѧ������4����δ������Һ��ɺ�ɫ��˵��Fe2+ ����____�ԡ��ɴ˿�֪��ʵ�����к�Fe2+������Һ��Ҫ���������ƣ��������ƺ�Fe2+������ҺʱӦ��������____________��
���𰸡� 3Fe+4H2O(g)![]() Fe3O4+4H2 ���۵����壬����������ˮ�����ĽӴ���� ���Ƭ ��ֹ���� һ����Fe3O4,������Fe Fe3O4��Fe Fe+ 2Fe3+= 3Fe2+ FeSO4+2NaOH=Fe(OH)2+Na2SO4 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 ��ԭ ����
Fe3O4+4H2 ���۵����壬����������ˮ�����ĽӴ���� ���Ƭ ��ֹ���� һ����Fe3O4,������Fe Fe3O4��Fe Fe+ 2Fe3+= 3Fe2+ FeSO4+2NaOH=Fe(OH)2+Na2SO4 4Fe(OH)2+O2+2H2O= 4Fe(OH)3 ��ԭ ����
�����������⿼��ʵ�鷽����������ۣ���1����ʵ����֤����ˮ������Ӧ���˷�Ӧ����ʽΪ��3Fe+4H2O(g) ![]() Fe3O4+4H2����2��ʯ���������������۵����壬����������ˮ�����ĽӴ������Ϊ��ֹҺ��ı��У������ƿ��Ӧ���ȼ����ʯ�����Ƭ����3������ҺB�еμ�KSCN��Һ����Һ��죬˵����ҺB�к���Fe3��������������һ������Fe3O4�����ܺ�������û�з�Ӧ��Fe�������Һ����죬˵����Һ�в���Fe3��������������һ������Fe3O4��Fe����4��Fe3O4�����ᷴӦ����Fe3����Fe2����Fe��Fe3��������Ӧ��Fe��2Fe3��=3Fe2������5������NaOH���ְ�ɫ��������ɫ����ΪFe(OH)2������FeSO4��2NaOH=Fe(OH)2����Na2SO4��Ѹ��ת��ɻ���ɫ������Ϊ���ɫ��������ΪFe(OH)2������������Fe(OH)3�������ķ�Ӧ����ʽΪ4Fe(OH)2��O2��2H2O=4Fe(OH)3����6����4����δ������Һ��죬˵��Fe2��������������Fe3��������Fe2���Ļ�ԭ�ԣ���ֹFe2����������Fe3��������Fe2��ʱ��Ҫ�������������ۻ���м��
Fe3O4+4H2����2��ʯ���������������۵����壬����������ˮ�����ĽӴ������Ϊ��ֹҺ��ı��У������ƿ��Ӧ���ȼ����ʯ�����Ƭ����3������ҺB�еμ�KSCN��Һ����Һ��죬˵����ҺB�к���Fe3��������������һ������Fe3O4�����ܺ�������û�з�Ӧ��Fe�������Һ����죬˵����Һ�в���Fe3��������������һ������Fe3O4��Fe����4��Fe3O4�����ᷴӦ����Fe3����Fe2����Fe��Fe3��������Ӧ��Fe��2Fe3��=3Fe2������5������NaOH���ְ�ɫ��������ɫ����ΪFe(OH)2������FeSO4��2NaOH=Fe(OH)2����Na2SO4��Ѹ��ת��ɻ���ɫ������Ϊ���ɫ��������ΪFe(OH)2������������Fe(OH)3�������ķ�Ӧ����ʽΪ4Fe(OH)2��O2��2H2O=4Fe(OH)3����6����4����δ������Һ��죬˵��Fe2��������������Fe3��������Fe2���Ļ�ԭ�ԣ���ֹFe2����������Fe3��������Fe2��ʱ��Ҫ�������������ۻ���м��