题目内容
四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中信息回答下列问题。
(1)W元素在周期表的位置为______________。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质与其它三种物质在一定条件下均能发生化学反应,该元素是_________(填元素名称)。
(3)X元素的最高价氧化物对应的水化物与其气态氢化物反应得到的化合物为___________(填化学式)。
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为_____________________________________。
(5)下列可作为比较Z和Mg金属性强弱的方法是_______(填代号)。
a.测两种元素单质的硬度和熔、沸点
b.测等浓度相应氯化物水溶液的pH
c.比较单质与同浓度盐酸反应的剧烈程度
d.比较两种元素在化合物中化合价的高低
(6)Z单质和Mg组成的混合物是一种常见的焰火材料,某化学兴趣小组设计了如下图所示的实验方案,测定该混合物中Z的质量分数。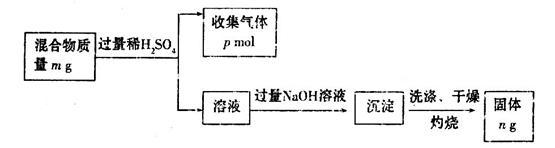
能确定混合物中Z的质量分数的数据组有_________(填代号)。
a.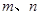 b.
b.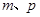 c.
c.
(1)第三周期 第ⅣA族(2分)
(2)钠(2分)
(3)NH4NO3 (2分)
(4)Al3++4OH-=[Al(OH)4]- (2分)
(5)bc (2分)
(6)abc (2分)
解析试题分析:由表中信息可得X为N,Y为Na,Z为Al,W为Si。
(1)Si在元素周期表的位置为第三周期 第ⅣA族。
(2)氢氧化钠可以和硝酸、氢氧化铝、硅酸均可以反应。
(3)氨气和硝酸反应:NH3++HNO3=NH4NO3.
(4)略
(5)金属性强弱的方法有:比较最高价氧化物对应水化物的碱性强弱,比较置换出氢的难易程度,另外比较等浓度相应氯化物水溶液的pH也可以,pH越小,金属性越弱。
(6)a.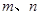 w =1-(3n)/(5m)
w =1-(3n)/(5m)
b.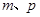 设Al的物质的量为x,Mg的物质的量为y,则y+3x/2=p,27x+24y=m,可解得x,y。就可以求出Z的质量分数。
设Al的物质的量为x,Mg的物质的量为y,则y+3x/2=p,27x+24y=m,可解得x,y。就可以求出Z的质量分数。
c. 设Al的物质的量为x,Mg的物质的量为y,y+3x/2=p,40y=n。可解得x,y。就可以求出Z的质量分数
设Al的物质的量为x,Mg的物质的量为y,y+3x/2=p,40y=n。可解得x,y。就可以求出Z的质量分数
考点:元素周期律和元素周期表

 阅读快车系列答案
阅读快车系列答案X、Y、Z、W是元素周期表前四周期的常见元素,其相关信息如下表:
| X | X的一种核素的质子数为56,中子数为30 |
| Y | 海水中元素含量最高的金属元素 |
| Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
| W | 价电子的排布式为3s23p3 |
(1)Z元素在元素周期表中的位置为 ,Z的电负性比W的 (填“大”或“小”)。
(2)X元索的基态原子电子排布式是 _ ,其有___种运动状态不同的电子。该元素的白色氧氧化物在空气中会迅速变成灰绿色。最后变成红褐色、其反应的化学方程式为 。
(3)Y的单质在工业上用途广泛,工业上以YW制取Y单质的化学方程式为 。
(4)设计实验验证Z和W的非金属性的强弱: 。
abcd是四种短周期元素。a、b、d同周期,c、d同主族.a原子结构示意图 ,b与c形成化合物的电子式为如图
,b与c形成化合物的电子式为如图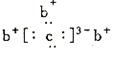 。下列比较中正确的是
。下列比较中正确的是
| A.原子半径:a >c>d | B.非金属性:a >b>d |
| C.单质的熔点:c> a | D.最高价氧化物对应的水化物的酸性:c>d>a |
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
| A.原子半径的大小顺序为W>Q>Z>X>Y |
| B.元素X的气态氢化物与Q的单质可发生置换反应 |
| C.元素X与Y可以形成5种以上的化合物 |
| D.元素Q的最高价氧化物对应的水化物酸性比W的强 |