题目内容
【题目】某研究性学习小组同学取V L浓缩的海水,用下图所示装置模拟工业法提溴。回答下列问题:
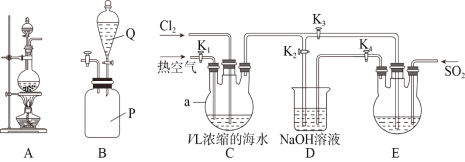
(1)装置A可用于实验室制备氯气,其反应原理为________________________________(用离子方程式表示),装置B是SO2贮气瓶,则Q中的溶液为________________。
(2)溴的富集过程:
①通入氯气与通入热空气的顺序是先通______________,通入氯气时K1、K2、K3的关、开方式是___________________。
②装置D的作用是_______________________________,通入SO2时装置E中发生反应的化学方程式为______________________________________。
(3)溴的精制:
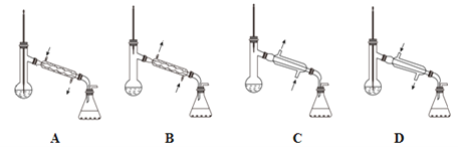
①待装置E中Br-全部转化为单质后,再利用下图中的____________(填字母)装置进行蒸馏即可得到纯溴。
②假设最终得到m g纯溴,实验中溴的利用率为b%,则浓缩海水中c(Br-)=______________.
【答案】![]() 饱和NaHSO3溶液 Cl2 或氯气 关闭K1、K3,打开K2 吸收尾气,防止其污染空气 SO2+Br2+2H2O=2HBr+ H2SO4 C
饱和NaHSO3溶液 Cl2 或氯气 关闭K1、K3,打开K2 吸收尾气,防止其污染空气 SO2+Br2+2H2O=2HBr+ H2SO4 C ![]() mol/L或
mol/L或![]() mol/L
mol/L
【解析】
(1)装置A为固液加热装置,实验室用浓盐酸与二氧化锰在加热的条件下制备氯气
其反应原理为MnO2+4H++2Cl-![]() Mn2 ++Cl2↑+2H2O;装置B是SO2贮气瓶,酸性气体SO2难溶于对应酸式盐溶液,在取用二氧化硫时,可加入饱和NaHSO3溶液后可将SO2排出,并无损失;
Mn2 ++Cl2↑+2H2O;装置B是SO2贮气瓶,酸性气体SO2难溶于对应酸式盐溶液,在取用二氧化硫时,可加入饱和NaHSO3溶液后可将SO2排出,并无损失;
(2)①热空气的作用是将溴单质从溶液中吹出,从而达到富集溴的目的,因此应向溶液中先通一段时间氯气,将溴离子转化为溴单质,再通入热空气,将溴从溶液中分离出来;通入氯气时应关闭K3,防止氯气进入装置E影响后续制取结果,多余的氯气有毒,不能排放到大气中,应打开K2用碱液吸收,关闭K1;
②装置D的作用吸收尾气,防止其污染空气;通入SO2时装置E中的溴单质与SO2发生反应生成溴化氢和硫酸,化学方程式为SO2+Br2+2H2O=2HBr+ H2SO4;
(3)①在进行蒸馏操作过程中,仪器温度计用来测得蒸馏出的蒸汽的温度,温度计的水银球应在蒸馏烧瓶的支管口处,对蒸馏出的蒸汽进行冷凝,冷凝管内通入冷凝水的方向为下进上出;
②根据反应Cl2+2Br-=2Cl-+Br2可知,生成1mol Br2,消耗2mol Br-,现制得m g纯溴,则消耗Br-的物质的量为![]() ,由于实验中溴的利用率为b%,则浓缩海水中Br-的总物质的量为
,由于实验中溴的利用率为b%,则浓缩海水中Br-的总物质的量为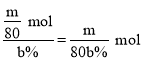 ,则浓缩海水中c(Br)=
,则浓缩海水中c(Br)=![]() =
=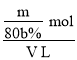 =
=![]() mol/L或
mol/L或![]() mol/L。
mol/L。

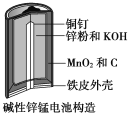
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。放电时总反应为:Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH。
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图所示:
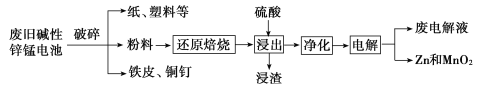
回答下列问题:
(1)MnOOH中,Mn元素的化合价为_________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有_________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+沉淀完全。常温下,已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol/L,根据下列数据计算,调节pH的合理范围是______至__________。(离子浓度小于1×10-5 mol/L即为沉淀完全)
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_________。本工艺中应循环利用的物质是_______(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2,且生成一种黄绿色气体,“粉料”中的MnOOH与盐酸反应的化学方程式为__________。