题目内容
在某恒容密闭容器中进行如下可逆反应:2M(g)+N(g)  W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
D
解析

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2 (g) 2NO2(g)
2NO2(g)
②2NO2(g) N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是
| A.前5min反应的平均速率v(N2O4)=0.18mol·(L·min)-1 |
| B.T1℃时反应②的化学平衡常数K=0.6 |
| C.反应①、②均为吸热反应 |
| D.若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
为了变废为宝,控制温室效应,工业上可用CO2来生产甲醇。一定条件下发生如下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是
CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是
| A.降低温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出来 |
| D.再充入1 mol CO2和3 mol H2 |
某可逆反应正向反应过程中能量变化如图所示,下列说法正确的是( )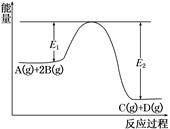
| A.该反应为吸热反应 |
| B.当反应达到平衡时,降低温度,A的转化率减小 |
| C.升高温度平衡常数K增大;压强增大,平衡向正反应方向移动 |
| D.加入催化剂,反应速率增大,E1减小,E2减小,反应热不变 |
反应N2O4(g)  2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是 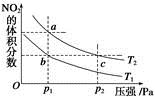
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a深、c浅 |
| C.a、b两点气体的平均相对分子质量:a>b |
| D.b、c两点化学平衡常数:b<c |
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2 min末该反应达到平衡,生成 0.8 mol D,并测得C的浓度为0.2 mol·L-1,下列判断正确的是
xC(g)+2D(g)。2 min末该反应达到平衡,生成 0.8 mol D,并测得C的浓度为0.2 mol·L-1,下列判断正确的是
| A.平衡常数约为0.3 |
| B.B的转化率为60% |
| C.A的平均反应速率为0.3 mol/(L·min) |
| D.若混合气体的密度不变则表明该反应达到平衡状态 |
为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是( )
| A.将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同 |
| B.盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 |
| C.将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快 |
| D.升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
铜锌原电池(如图)工作时,下列叙述正确的是( )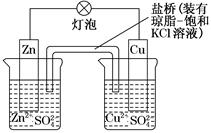
| A.正极反应为:Zn―→Zn2++2e- |
| B.电池反应为:Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.盐桥中的K+移向ZnSO4溶液 |
下列说法不正确的是( )
| A.焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行 |
| B.自发进行的反应一定能迅速进行 |
| C.在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 |
| D.一个反应能否自发进行,可用焓变和熵变共同判断 |