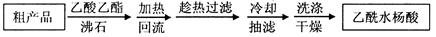题目内容
某科研小组以难溶性钾长石(K2O?Al2O3?6SiO2)为原料,提取A12O3、 K2CO3等物质,工艺流程如下: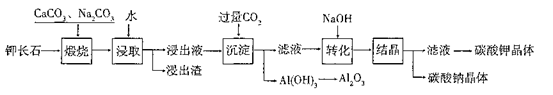
(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式_____________________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和 KAlO2,写出Al2O3转化为NaAlO2的化学方程式____________________________。
(2)已知NaAlO2和KAlO2易发生如下反应:AlO2-+2H2O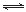 Al(OH)3+OH-。
Al(OH)3+OH-。
“浸取”时,应保持溶液呈______性(填“酸”或“碱”)。“浸取”时不断搅拌的目的是______________。
(3)“转化”时加入NaOH的主要作用是_______ (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______、_______和水。
(1)①CaCO3+SiO2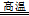 CaSiO3+CO2↑ (3分)
CaSiO3+CO2↑ (3分)
②Na2CO3+Al2O3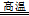 2NaAlO2+CO2↑ (3分)
2NaAlO2+CO2↑ (3分)
3 CuCl FeCl2(3分)
② Cl-+ CuCl = [CuCl2]-(2分)
③ 4FeCO3 + O2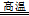 4CO2 + 2Fe2O3(3分)
4CO2 + 2Fe2O3(3分)
④ CuCl2、 NaCl (4分)
(2)(共4分)不会产生SO2污染大气(2分),不用煅烧黄铜矿从而节约热能 [或可得副产品铁红和硫,合理答案都行。2分]
解析试题分析:(1)①读图可知,缺少的生成物为FeCl2、CuCl,硫元素由—2升为0,设CuFeS2的系数为1,则2个硫原子升高总数为4,铜元素由+2降为+1,1个铜原子降低数为1,由于升降总数相等,则铁元素由+3降为+2,需要3个铁原子降低总数3,则CuFeS2+3FeCl3=CuCl+4FeCl2+2S;②依题意,难溶的CuCl与可溶的NaCl在水中发生反应,其原理为Cl-+ CuCl = [CuCl2]-;③依题意,该反应的反应物是FeCO3和O2,生成物是Fe2O3和CO2,铁元素由+2升为+3价,氧元素由0降为—2价,根据最小公倍数法配平可得:4FeCO3 + O2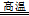 4CO2 + 2Fe2O3;依题意,Na[CuCl2]在水中发生反应V,铜元素由+1部分升高为+2,部分降低为0,则溶液A中含有Cl-、Cu2+和Na+,所以推断A的溶质主要是CuCl2和NaCl;(2)传统方法需要高温煅烧,不仅消耗大量的能量,而且还产生大量的SO2等有毒气体,污染空气,新方法的优点是不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能,可得副产品铁红和硫。
4CO2 + 2Fe2O3;依题意,Na[CuCl2]在水中发生反应V,铜元素由+1部分升高为+2,部分降低为0,则溶液A中含有Cl-、Cu2+和Na+,所以推断A的溶质主要是CuCl2和NaCl;(2)传统方法需要高温煅烧,不仅消耗大量的能量,而且还产生大量的SO2等有毒气体,污染空气,新方法的优点是不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能,可得副产品铁红和硫。
考点:考查有关物质制备的化学工艺流程推断题,涉及化学方程式的配平、主要流程中离子方程式、推断溶液的主要溶质、评价两种工艺的优缺点等。

以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
(1)硫酸渣的成分中属于两性氧化物的是 , 写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: ;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B可以回收的物质有______________________;
(4)简述洗涤过程的实验操作 ;
(5)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为 (用最简分数表达式表示)。
(已知相对原子质量:O 16 S 32 Fe 56 )
为了达到下列表格中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中。
| 实验要求 | 试剂及方法 |
| 证明明矾水溶液呈酸性 | |
| 鉴别甲烷与乙烯 | |
| 除去MgO中含有的Al2O3 | |
| 鉴别乙醇和乙醛 | |
供选择的化学试剂及实验方法
A.新制的Cu(OH)2
B.加盐酸,过滤
C.将溶液滴在pH试纸上
D.加入过量浓NaOH溶液,过滤
E.酸性KMnO4溶液
多彩水泥的添加剂是CoCl2-6H2O。工定是以含钴废料(含少量Fe、Al等杂质制取CoCl2·6H2O的一种新工艺流程如下图:
已知:①钴与盐酸反应的化学方程式为:Co+2HCl CoCl2+H2↑
②CoCl2·6H2O溶点86oC,易溶于水、乙醚等;常温下稳定无毒,加热至110oC~120OC时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)上述流程中的试剂a可能为 ;其作用是 ;
(2)加入碳酸钠调节pH至b,b的范围是 ;
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
(3)操作1是 ;滤渣的成分为 ;
(4)操作2的过程为蒸发浓缩、 和过滤。
(5)制得的CoCl2·6H2O需减压烘干的原因是 。
(18分)NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
_____________________________________________________。
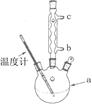
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
| A.铁 | B.铝 | C.铂 | D.玻璃 |

(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反就开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是___________________________________。
②让反应停止的操作方法及原因是________________________。
(4)以下收集NO气体的装置,合理的是________(填选项代号)。

(5)假设实验中12.8 g Cu全部溶解,需要通入标况下________mL O2才能使NO全部溶于水。
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是___________________________________________。

 、
、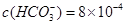
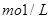 。要软化10 m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3 g。
。要软化10 m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3 g。
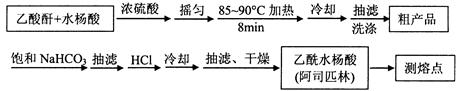
 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: