题目内容
(14分)硒34Se和碲52Te都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上用硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下: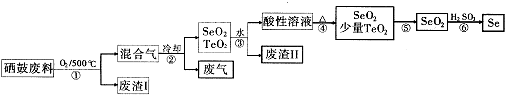
已知:
(1)Se的氢化物的电子式是____。
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是 。
(3)废气的主要成分是____ ;废渣II的主要成分是 。
(4)步骤④中主要反应的化学方程式是 ;步骤⑥反应的化学方程式是 。
(5)根据表中数据,步骤⑤最适宜的分离方法是 。
(14分)
(1)
(2)增大接触面积,加快反应速率,使废料充分燃烧
(3)CO2 TeO2
(4)H2SeO3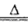 SeO2+ H2O 2H2SO3+SeO2=Se+2H2SO4
SeO2+ H2O 2H2SO3+SeO2=Se+2H2SO4
(5)升华,将温度控制在315°C到450°C之间
解析试题分析:(1)Se是第六主族元素,氢化物的化学式与H2O相似,属于共价化合物,电子式为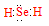 ;
;
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是增大接触面积,加快反应速率,使废料充分燃烧
(3)根据硒鼓废料的成分判断,废气是CO2;SeO2易溶于水,TeO2微溶于水,所以废渣主要是TeO2;
(4)SeO2溶于水生成H2SeO3,受热分解生成SeO2,化学方程式为H2SeO3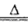 SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
(5)根据SeO2和TeO2升华的温度,二者分离的最适宜方法是升华。
考点:考查Se元素的性质,电子式、化学方程式的书写,物质分离方法的判断

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案现有苯甲酸、苯酚溶于乙醇所得的混合液,某同学设计方案分离三种物质,并检验其中的某些离子和物质。
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚> HCO3- (2)部分物理参数如下:
| | 密度 (g·mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 |
| 苯甲酸 | 1.2659 | 122.13℃ | 249℃ | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 | 1.07 | 40.6 | 181.9 | 易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 | 0.79 | -114.3 °C | 78.5 | 与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂 |
供选择试剂:10%氢氧化钠溶液、0.1mol/L盐酸、0.1mol/LNa2CO3、0.1mol/L NaHCO3、浓溴水、生石灰、0.1mol/L FeCl3、0.1mol/L BaCl2、CO2、0.1mol/L溴水、澄清石灰水
(1)分离物质流程如下:

①物质C是_____________,操作IV是_____________。
②操作III发生的主要化学反应方程式_________________ _______________________________。
③混合液2中加入生石灰的原因是_______。
(2)该同学检验混合液1中是否含有苯酚和NaHCO3,以证明酸性的强弱。
| 实验步骤 | 现象和结论 |
| ①取少量混合液1于试管,滴加________________________, 振荡,静置 | |
| ②取少量步骤①上层清夜于试管,滴加__________________ ____________________________________________________ | 澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加___________________,振荡 | _________________________, 说明混合液1不含有酚羟基 |
(3)称取2.0g苯甲酸和苯酚的混合固体溶于足量乙醇中,滴加足量饱和NaHCO3溶液,测得放出的CO2(标准状况下,不考虑CO2溶于水)为33.6mL ,则苯甲酸的质量分数为_________________________(只列式,不计算),结果为________。(结果保留1位小数)(苯甲酸的相对分子质量为122,苯酚相对分子质量为94)
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH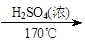 CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚;浓硫酸把乙醇氧化为CO2等。
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/oC | 78.5 | 132 | 34.6 |
| 熔点/oC | -130 | 9 | -116 |
(1)A装置上方使用滴液漏斗的优点是:_________________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_____________________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)B装置的作用是_____________________________________。
(3)在装置C中应加入________(填正确选项前的字母),其目的是______________。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是____________________________.
(5)D装置具支试管内若用溴水代替液溴(假定产物相同),分析其优点________________。
(6)反应过程中应用冷水冷却装置D,其主要目的是_____________;但又不能过度冷却(如用冰水),其原因是_________________________。
(16分)氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。 当悬浮物较多时,停止制备。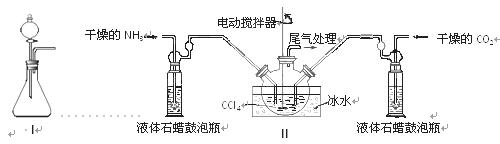
注:CCl4与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是_________________________________________,液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 | ,证明固体中含有碳酸氢铵。 |
氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下: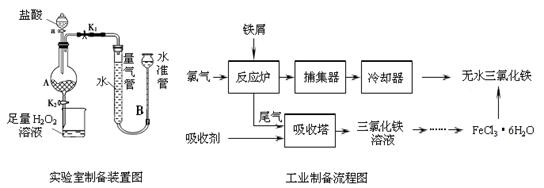
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2) 废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当 时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是__________。
(3)从FeCl3溶液制得FeCl3?6H2O晶体的操作步骤是:加入 _ 后、 _ 、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式: 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol?L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定终点的现象是: _
②样品中氯化铁的质量分数 _

 Al(OH)3+OH-。
Al(OH)3+OH-。

