题目内容
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有 、 (填化学式)。
(2)检验蒸馏水的纯度时,最简单易行的方法是测定水的 。
(3)水的净化与软化的区别是:水的净化是用混凝剂(如明矾等)使 _,而水的软化是________。
(4)通过施加一定压力使水分子透过半透膜而将大分子或离子截留,从而使水得以净化的方法称为 ;电渗析法净化水时,使离子通过半透膜的推动力是 。
(5)某天然水中 、
、
 。要软化10 m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3 g。
。要软化10 m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3 g。
(1)O2、CO2(或N2) (2)电导率或电阻率
(3)水中胶体及悬浮物沉淀下来;除去水中的Ca2+和Mg2+
(4)反渗透法;电场力或电势差
(5)740;1484
解析试题解析:(1)天然水中溶解的气体主要是CO2、O2等。
(2)因水中溶有的离子浓度不同,则水的电导率不同,因此可通过测量电导率检验水的纯度。
(3)净化是利用胶体的吸附性,将水中悬浮的杂质除去;水的软化是指除去水中的Ca2+、Mg2+,降低水的硬度。
(4)使用半透膜除去某些离子的方法属于渗透法。电渗析法推动离子的动力属于电场力。
(5)加入Ca(OH)2后,OH-先沉淀Mg2+,然后再和HCO3-反应生成CaCO3,据此有:Ca(OH)2~Mg2+,Ca(OH)2~2HCO3-,故需要Ca(OH)2的物质的量为6×10-4×10×103+ ×8×10-4×10×103=10mol,质量为74g/mol×10mol=740g。溶液中的Ca2+先和第一步产生的碳酸根反应,剩余的Ca2+则需要加入碳酸钠来沉淀,因此需要碳酸钠的物质的量为:1.2×10-3×10×103+10-8×10-4×10×103=14mol,则碳酸钠的质量为:106g/mol×14mol=1484g。
×8×10-4×10×103=10mol,质量为74g/mol×10mol=740g。溶液中的Ca2+先和第一步产生的碳酸根反应,剩余的Ca2+则需要加入碳酸钠来沉淀,因此需要碳酸钠的物质的量为:1.2×10-3×10×103+10-8×10-4×10×103=14mol,则碳酸钠的质量为:106g/mol×14mol=1484g。
考点:考查水的净化、软化原理及数据处理。

 精英口算卡系列答案
精英口算卡系列答案醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下: ① NaBr+H2SO4 = HBr+NaHSO4;②R-OH+HBr R-Br+H2O
R-Br+H2O
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下
| | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴代烃的水溶性 (填“大于”、“等于”或“小于”)相应的醇;其原因是 。
(2)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层”、“下层”或“不分层”)。
(3)制备操作中,加入的浓硫酸必须进行稀释,目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 ;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是 。
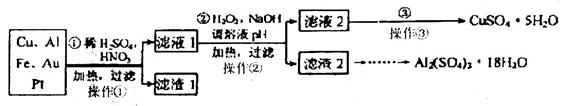
从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2等)中回收V2O5的一种生产工艺流程示意图如下,请回答下列问题: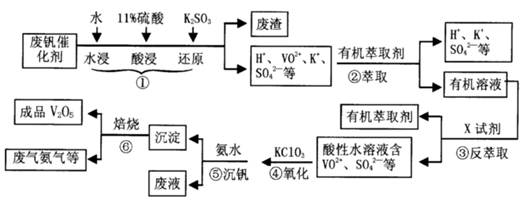
(1)步骤①中废渣的主要成分是 ,③中X试剂为 。
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是 。
(3)②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)。
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是 。
2RAn(有机层) + nH2SO4 (水层)为提高②中萃取百分率,应采取的措施是 。
(4)请完成④中的反应离子方程式:
□ClO3- + □VO2+ +□H+ =□VO3+ + □ +□
(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH值为 。
(6)该工艺流程中,可以循环利用的物质有 。
现有苯甲酸、苯酚溶于乙醇所得的混合液,某同学设计方案分离三种物质,并检验其中的某些离子和物质。
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚> HCO3- (2)部分物理参数如下:
| | 密度 (g·mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 |
| 苯甲酸 | 1.2659 | 122.13℃ | 249℃ | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 | 1.07 | 40.6 | 181.9 | 易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 | 0.79 | -114.3 °C | 78.5 | 与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂 |
供选择试剂:10%氢氧化钠溶液、0.1mol/L盐酸、0.1mol/LNa2CO3、0.1mol/L NaHCO3、浓溴水、生石灰、0.1mol/L FeCl3、0.1mol/L BaCl2、CO2、0.1mol/L溴水、澄清石灰水
(1)分离物质流程如下:

①物质C是_____________,操作IV是_____________。
②操作III发生的主要化学反应方程式_________________ _______________________________。
③混合液2中加入生石灰的原因是_______。
(2)该同学检验混合液1中是否含有苯酚和NaHCO3,以证明酸性的强弱。
| 实验步骤 | 现象和结论 |
| ①取少量混合液1于试管,滴加________________________, 振荡,静置 | |
| ②取少量步骤①上层清夜于试管,滴加__________________ ____________________________________________________ | 澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加___________________,振荡 | _________________________, 说明混合液1不含有酚羟基 |
(3)称取2.0g苯甲酸和苯酚的混合固体溶于足量乙醇中,滴加足量饱和NaHCO3溶液,测得放出的CO2(标准状况下,不考虑CO2溶于水)为33.6mL ,则苯甲酸的质量分数为_________________________(只列式,不计算),结果为________。(结果保留1位小数)(苯甲酸的相对分子质量为122,苯酚相对分子质量为94)
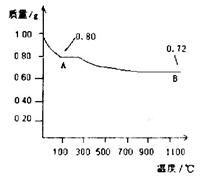
(14分)某物质用途广泛,可用作分析试剂、媒染剂、催化剂及化工原料。经测定它含有铁元素,摩尔质量为482g/mol。为进一步确定它的组成,某化学兴趣小组做了以下实验:
Ⅰ.称取48.20g该物质溶于水,配成100mL溶液,所得溶液显棕黄色。
Ⅱ.取上述溶液50mL于试管中,加入足量的0.1mol/LNaOH溶液,并加热,产生的气体经干燥后通入浓硫酸中,浓硫酸增重0.85g;产生的红褐色沉淀经过过滤、洗涤、灼烧后得4.00g固体。
Ⅲ.另取上述溶液50mL于试管中,加入足量的BaCl2溶液,产生不溶于盐酸的白色沉淀 23.30g。
请回答下列问题:
(1)实验Ⅱ中产生气体的电子式 。
(2)该物质的化学式为 ,下列有关该物质的用途合理的是 。
| A.补血剂 | B.净水剂 | C.含酚废水的检测试剂 | D.肥料 |
(4)将SO2气体通入该物质的溶液中可以观察到的实验现象是 ,写出该反应的离子方程式 。
(5)为了进一步验证该物质中铁元素的化合价,某同学设计了如下实验方案:取少量固体于试管中,加水充分溶解,滴加硫氰化钾溶液,若溶液显血红色,即可证明该物质中一定存在Fe3+。请评价该实验操作是否合理 (填“合理”或者“不合理”),理由 。

 Al(OH)3+OH-。
Al(OH)3+OH-。