题目内容
(18分)NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
_____________________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
| A.铁 | B.铝 | C.铂 | D.玻璃 |

(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反就开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是___________________________________。
②让反应停止的操作方法及原因是________________________。
(4)以下收集NO气体的装置,合理的是________(填选项代号)。

(5)假设实验中12.8 g Cu全部溶解,需要通入标况下________mL O2才能使NO全部溶于水。
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是___________________________________________。

Ⅰ.(1)3Cu+8H++2NO3-===3Cu2++4H2O+2NO↑ (2)①C、D ②2NO+O2===2NO2
(3)①接收被气体压出U形管的液体,防止稀硝酸溢出
②关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止。
(4)C、D (5)2.24 L
II.丁 制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体。
解析试题分析:Ⅰ.(1)金属铜可以和稀硝酸之间反应生成硝酸铜、一氧化氮以及水,即3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,离子方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O。
(2)①实验室若没有铜丝,铜粒以代替铜丝进行实验,则包裹桶里的不能是金属铁以及金属铝,因为他们的活泼性强于金属铜,会先于金属铜和硝酸之间发生反应,故答案为:C、D。
②试管内有空气,NO容易被氧化为红棕色的气体二氧化氮,即2NO+O2═2NO2。
(3)①一氧化氮是难溶于水的气体,当制取一氧化氮的装置产生一氧化氮气体时,气体难溶于水,气体把U形管的液体压出,所以长玻璃管的作用是:接收被气体压出U形管的液体,防止稀硝酸溢出。
②让反应停止的操作方法及原因是:关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止。
(4)NO能与O2反应,不能用排空气法收集,NO难溶于水,可用排水法收集,故C、D正确。
(5)铜和硝酸反应,铜失去电子,硝酸得到电子变成一氧化氮,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,一氧化氮和氧气和水反应生成硝酸,4NO+2H2O+3O2=4HNO3,氧气得电子,一氧化氮失去电子,所以铜失去的电子数等于氧气得到的电子数,12.8g Cu为 0.2mol,全部溶解,失去0.4mol电子,1个氧分子得到4个电子变成-2价的氧,所以需氧气0.1mol,0.1mol氧气在标准状况下的体积为2.24 L。
II.Cu与浓硝酸或稀硝酸反应分别生产NO2、NO等污染环境的有毒气体,丙方案用到Cl2,能污染环境,制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体,所以4种方法中最好的是丁。
考点:本题考查实验方案的设计与评价、方程式的书写、化学计算。

现有苯甲酸、苯酚溶于乙醇所得的混合液,某同学设计方案分离三种物质,并检验其中的某些离子和物质。
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚> HCO3- (2)部分物理参数如下:
| | 密度 (g·mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 |
| 苯甲酸 | 1.2659 | 122.13℃ | 249℃ | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 | 1.07 | 40.6 | 181.9 | 易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 | 0.79 | -114.3 °C | 78.5 | 与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂 |
供选择试剂:10%氢氧化钠溶液、0.1mol/L盐酸、0.1mol/LNa2CO3、0.1mol/L NaHCO3、浓溴水、生石灰、0.1mol/L FeCl3、0.1mol/L BaCl2、CO2、0.1mol/L溴水、澄清石灰水
(1)分离物质流程如下:

①物质C是_____________,操作IV是_____________。
②操作III发生的主要化学反应方程式_________________ _______________________________。
③混合液2中加入生石灰的原因是_______。
(2)该同学检验混合液1中是否含有苯酚和NaHCO3,以证明酸性的强弱。
| 实验步骤 | 现象和结论 |
| ①取少量混合液1于试管,滴加________________________, 振荡,静置 | |
| ②取少量步骤①上层清夜于试管,滴加__________________ ____________________________________________________ | 澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加___________________,振荡 | _________________________, 说明混合液1不含有酚羟基 |
(3)称取2.0g苯甲酸和苯酚的混合固体溶于足量乙醇中,滴加足量饱和NaHCO3溶液,测得放出的CO2(标准状况下,不考虑CO2溶于水)为33.6mL ,则苯甲酸的质量分数为_________________________(只列式,不计算),结果为________。(结果保留1位小数)(苯甲酸的相对分子质量为122,苯酚相对分子质量为94)
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚;浓硫酸把乙醇氧化为CO2等。
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示: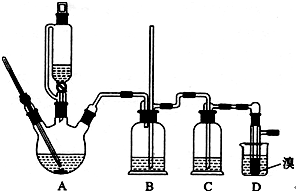
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/oC | 78.5 | 132 | 34.6 |
| 熔点/oC | -130 | 9 | -116 |
(1)A装置上方使用滴液漏斗的优点是:_________________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_____________________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)B装置的作用是_____________________________________。
(3)在装置C中应加入________(填正确选项前的字母),其目的是______________。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是____________________________.
(5)D装置具支试管内若用溴水代替液溴(假定产物相同),分析其优点________________。
(6)反应过程中应用冷水冷却装置D,其主要目的是_____________;但又不能过度冷却(如用冰水),其原因是_________________________。
(14分)某物质用途广泛,可用作分析试剂、媒染剂、催化剂及化工原料。经测定它含有铁元素,摩尔质量为482g/mol。为进一步确定它的组成,某化学兴趣小组做了以下实验:
Ⅰ.称取48.20g该物质溶于水,配成100mL溶液,所得溶液显棕黄色。
Ⅱ.取上述溶液50mL于试管中,加入足量的0.1mol/LNaOH溶液,并加热,产生的气体经干燥后通入浓硫酸中,浓硫酸增重0.85g;产生的红褐色沉淀经过过滤、洗涤、灼烧后得4.00g固体。
Ⅲ.另取上述溶液50mL于试管中,加入足量的BaCl2溶液,产生不溶于盐酸的白色沉淀 23.30g。
请回答下列问题:
(1)实验Ⅱ中产生气体的电子式 。
(2)该物质的化学式为 ,下列有关该物质的用途合理的是 。
| A.补血剂 | B.净水剂 | C.含酚废水的检测试剂 | D.肥料 |
(4)将SO2气体通入该物质的溶液中可以观察到的实验现象是 ,写出该反应的离子方程式 。
(5)为了进一步验证该物质中铁元素的化合价,某同学设计了如下实验方案:取少量固体于试管中,加水充分溶解,滴加硫氰化钾溶液,若溶液显血红色,即可证明该物质中一定存在Fe3+。请评价该实验操作是否合理 (填“合理”或者“不合理”),理由 。
(16分)氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。 当悬浮物较多时,停止制备。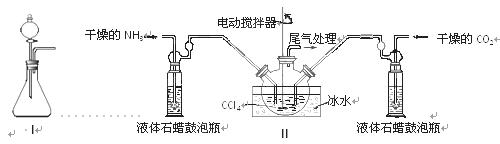
注:CCl4与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是_________________________________________,液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 | ,证明固体中含有碳酸氢铵。 |
(12分)【化学——化学与技术】
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O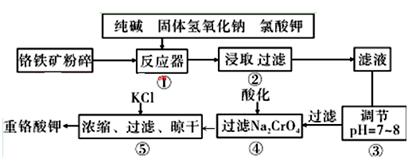
(1)碱浸前将铬铁矿粉碎的目的是 。
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式 。
(4)用简要的文字说明操作⑤加入KC1的原因
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
| A.x ="0.5" ,a =8 | B.x ="0.5" ,a =" 10" | C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
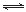 Al(OH)3+OH-。
Al(OH)3+OH-。