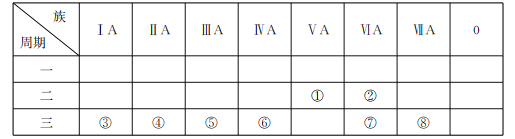
题目内容
【题目】汽车尾气中的有害气体主要有NO、碳氢化合物及CO,某校同学设计实验将模拟汽车尾气转化为无害气体。回答下列问题;
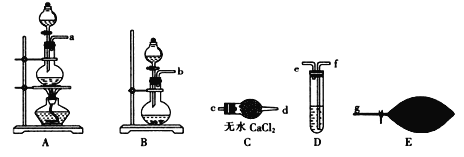
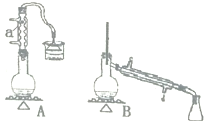
(1) 为了配制模拟尾气,甲组同学用上图所示装置分别制备NO、乙烯及CO三袋气体。
① 在实验室中用装置A制取NO,分液漏斗中盛放的是_______(填试剂名称)。
② 用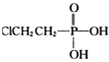 (乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为(已知磷转化为Na3 PO4)_______________________。
(乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为(已知磷转化为Na3 PO4)_______________________。
③ 用H2C2O4与浓硫酸制取CO的化学方程式:H2C2O4 ![]() CO↑ + CO2 ↑+ H2O↑,然后进行提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为(气流从左至右)___________→g,其中装置C中主要仪器的名称是________,装置D中盛放的药品是_______。
CO↑ + CO2 ↑+ H2O↑,然后进行提纯,选用上图装置预制一袋干燥纯净的CO,各接口连接的顺序为(气流从左至右)___________→g,其中装置C中主要仪器的名称是________,装置D中盛放的药品是_______。
(2) 乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气(NO、CO、C2 H4及空气),按如图所示装置进行尾气转化并检验。
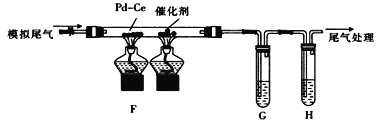
① 为检验催化反应后的气体中是否有CO2生成和乙烯的残留,G、H中盛放的试剂依次是_______(填标号)。
a. NaOH溶液 b. 酸性KMnO4溶液 c. 澄清石灰水 d. Br2/CCl4溶液
② 通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是__________________;写出其中CO与NO完全转化为无害气体的化学方程式:_____________________。
【答案】稀硝酸  +4NaOH → CH2=CH2↑+NaCl+Na3PO4+3H2O a→f→e→c→d (球形)干燥管 NaOH浓溶液 c b(或c d或d c) 使催化剂活性达到最大,利于CO2和C2H4的检验并减少模拟烟气的浪费 2CO+2NO=N2+2CO2
+4NaOH → CH2=CH2↑+NaCl+Na3PO4+3H2O a→f→e→c→d (球形)干燥管 NaOH浓溶液 c b(或c d或d c) 使催化剂活性达到最大,利于CO2和C2H4的检验并减少模拟烟气的浪费 2CO+2NO=N2+2CO2
【解析】
(1)①汽车尾气中的有害气体主要有NO、碳氢化合物及CO,设计实验将模拟汽车尾气转化为无害气体,装置A制取NO,分液漏斗中盛放的是稀硝酸,滴入烧瓶和铜反应生成一氧化氮;
②用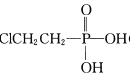 (乙烯利)与NaOH溶液并用装置B制取乙烯,同时生成Na3PO4和氯化氢;
(乙烯利)与NaOH溶液并用装置B制取乙烯,同时生成Na3PO4和氯化氢;
③用H2C2O4与浓硫酸制取CO(化学方程式为H2C2O4 ![]() CO+CO2+H2O)并提纯,发生装置为固液加热型装置,澄清石灰水可除去二氧化碳,干燥罐的氯化钙可吸收水蒸气,据此分析作答;
CO+CO2+H2O)并提纯,发生装置为固液加热型装置,澄清石灰水可除去二氧化碳,干燥罐的氯化钙可吸收水蒸气,据此分析作答;
(2)①澄清石灰水检验二氧化碳,用溴水或高锰酸钾溶液检验;
②通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是此时催化剂活性最大,反应进行的快,CO和NO在催化剂作用下反应生成氮气和二氧化碳。
(1)①用装置A制取NO,分液漏斗中盛放的是稀硝酸,滴入烧瓶和铜反应生成一氧化氮气体;
②用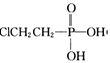 (乙烯利)与NaOH溶液并用装置B制取乙烯,磷转化为Na3PO4,同时生成氯化钠和水;
(乙烯利)与NaOH溶液并用装置B制取乙烯,磷转化为Na3PO4,同时生成氯化钠和水;
③用H2C2O4与浓硫酸制取CO(化学方程式为H2C2O4 ![]() CO+CO2+H2O)并提纯,选用上图装置预制一袋干燥纯净的CO,利用装置A加热得到草酸分解产物,通过装置D中的氢氧化钠溶液除去二氧化碳,通过装置C中氯化钙吸收水蒸气,得到干燥的CO,在E中收集一袋NO气体,D中是浓的氢氧化钠溶液用来吸收混合气体中的二氧化碳,各接口连接的顺序为:a→f→e→c→d→g;
CO+CO2+H2O)并提纯,选用上图装置预制一袋干燥纯净的CO,利用装置A加热得到草酸分解产物,通过装置D中的氢氧化钠溶液除去二氧化碳,通过装置C中氯化钙吸收水蒸气,得到干燥的CO,在E中收集一袋NO气体,D中是浓的氢氧化钠溶液用来吸收混合气体中的二氧化碳,各接口连接的顺序为:a→f→e→c→d→g;
(2)①乙组同学将甲组制得的气体与空气按适当比例混合形成模拟尾气(NO,CO,C2H4及空气),通过催化剂反应NO和CO反应生成氮气和二氧化碳,剩余的NO与空气反应,不会干扰乙烯的检验,为检验催化反应后的气体中是否有CO2生成和乙烯的残留,可以利用澄清石灰水检验二氧化碳,用溴水或高锰酸钾溶液检验,G、H中盛放的试剂依次是cb或dc或cd;
②通“模拟尾气”前,需先将催化剂加热到反应所需的温度,其目的是:使催化剂活性达到最大,利于CO2和C2H4的检验并减少模拟烟气的浪费,中CO与NO完全转化为无害气体的:2CO+2NO=N2+2CO2。

【题目】实验室用加热1一丁醇、浓H2SO4和溴化钠混合物的方法来制备1一溴丁烷,设计了如图所示的实验装置![]() 其中的夹持仪器已省略
其中的夹持仪器已省略![]() 。
。
已知:H2SO4+NaBr=NaHSO4+HBr, H2SO4(浓)+2HBr=Br2+SO2↑+2H2O
请回答下列问题:
(1)仪器a的名称为______。
(2)制备操作中,加入的浓硫酸事先要进行稀释,其目的是______![]() 填选项字母
填选项字母![]() 。
。
![]() 减少副产物烯和醚的生成
减少副产物烯和醚的生成![]() 减少
减少![]() 的生成
的生成![]() 水是反应的催化剂
水是反应的催化剂
(3)写出此实验制1一溴丁烷的总化学方程式______。
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“![]() ”,来确定副产物中是否存在丁醚
”,来确定副产物中是否存在丁醚![]() 请评价该同学设计的鉴定方案是否合理?理由是______。
请评价该同学设计的鉴定方案是否合理?理由是______。
(5)为了进一步提纯1一溴丁烷,该小组同学查得相关有机物的有关数据如表:
物质 | 熔点 | 沸点 |
1一丁醇 |
|
|
1一溴丁烷 |
|
|
丁醚 |
|
|
1一丁烯 |
|
|
则用B装置完成此提纯实验时;,实验中要迅速升高温度至______收集所得馏分。
(6)若实验中所取1一丁醇、NaBr分别为![]() 、
、![]() ,浓硫酸
,浓硫酸![]() ,蒸出的粗产物经洗涤,干燥后再次蒸馏得到
,蒸出的粗产物经洗涤,干燥后再次蒸馏得到![]() 一溴丁烷,则1一溴丁烷的产率是______
一溴丁烷,则1一溴丁烷的产率是______![]() 保留2位有效数字
保留2位有效数字![]() 。
。
【题目】某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
实验序号 | 加入试剂 | 实验现象 |
Ⅰ | 4 mL 2 mol·L-1HCl 溶液 | 沉淀溶解 |
Ⅱ | 4 mL 2 mol·L-1NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程_____________。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因___________。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是_________。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是____________。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是___________。
③乙同学这样配制混合溶液的理由是___________。