题目内容
20.A、B两个烧杯中分别盛有100mL3.0mol/L的盐酸和烧碱溶液,向两个烧杯中分别加入等质量的Al粉,在相同条件下产生气体的体积比A:B=2:5,则加入铝粉的质量为( )| A. | 8.1g | B. | 6.75g | C. | 5.4g | D. | 2.7 g |
分析 盐酸和氢氧化钠溶液中溶质的物质的量相同,加入铝的质量相同,若Al都完全反应,则生成氢气应相等,而应结束后测得生成的气体体积比为A:B=2:5,由方程式:2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知酸与金属反应时酸不过量,碱与金属反应时碱过量,结合方程式计算解答.
解答 解:盐酸和氢氧化钠溶液中溶质的物质的量相同,加入铝的质量相同,若Al都完全反应,则生成氢气应相等,而应结束后测得生成的气体体积比为A:B=2:5,由方程式:2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知酸与金属反应时酸不过量,碱与金属反应时碱过量.
盐酸和氢氧化钠溶液中溶质的物质的量均为0.1L×3mol/L=0.3mol,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,则:
2Al+6HCl═2AlCl3+3H2↑
6 3
0.3mol x
解得x=$\frac{0.3mol×3}{6}$=0.15mol,
则碱与金属铝反应生成的氢气的物质的量为0.15mol×$\frac{5}{2}$=0.375mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,则:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.375mol
解得y=$\frac{0.375mol×2}{3}$=0.25mol,
则铝的质量为0.25mol×27g/mol=6.75g,
故选:B.
点评 本题考查化学反应方程式的计算,关键是判断反应中酸、碱是否足量,难度中等.

| A. | 金属性强弱:Na>Mg>Al | B. | 酸性强弱:HIO4>HBrO4>HClO4 | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 原子半径大小:Na>S>O |
| A. | 碳酸钠(s) | B. | 醋酸钠(s) | C. | 硫酸钠(aq) | D. | 硫酸钾(s) |
| A. | 合金是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质 | |
| B. | 镁铝合金的熔点比镁和铝都髙 | |
| C. | 在合金中加入适量的稀土金属能大大改善其性能 | |
| D. | 青铜、硬铝、钢都是合金 |
| A. | K+、Cl-、NO3-、S2- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | K+、Fe2+、I-、SO42- | D. | Na+、Ca2+、Cl-、HCO3- |
关于这两种晶体的说法,正确的是( )
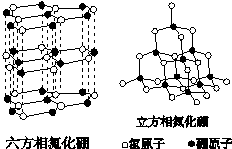
| A. | 立方相氮化硼含有σ键和π键,所以硬度大 | |
| B. | 六方相氮化硼层间作用力小,所以质地软 | |
| C. | 两种晶体中的既有极性键又有非极性键 | |
| D. | 两种晶体均为原子晶体 |
| A. | 若形成化学键释放的能量大于断裂化学键所吸收的能量,则是放热反应 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2 kJ/mol,可知红磷比白磷稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式可表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
| A. | 500mL | B. | 250mL | C. | 200mL | D. | 100mL |