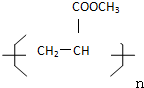题目内容
10.将标准状况下的H2S气体通入100mL 5mol?L-1的CuSO4溶液中,再向混合溶液中滴加2mol?L-1NaOH溶液,当溶液的pH=7时,滴入的NaOH溶液体积为( )| A. | 500mL | B. | 250mL | C. | 200mL | D. | 100mL |
分析 将标准状况下的H2S气体通入的CuSO4溶液中,发生反应:H2S+CuSO4=CuS↓+H2SO4,再向混合溶液中滴加NaOH溶液,当溶液的pH=7时,溶液中溶质为Na2SO4,根据硫酸根守恒计算Na2SO4,根据钠离子守恒计算NaOH物质的量,进而计算NaOH溶液体积.
解答 解:将标准状况下的H2S气体通入的CuSO4溶液中,发生反应:H2S+CuSO4=CuS↓+H2SO4,再向混合溶液中滴加NaOH溶液,当溶液的pH=7时,溶液中溶质为Na2SO4,根据硫酸根守恒n(Na2SO4)=n(CuSO4)=0.1L×5mol/L=0.5mol,根据钠离子守恒n(NaOH)=2n(Na2SO4)=1mol,故NaOH溶液体积为$\frac{1mol}{2mol/L}$=0.5L=500mL,
故选A.
点评 本题考查混合物有关计算,注意利用守恒法解答,侧重考查学生分析计算能力,难度中等.

练习册系列答案
相关题目
20.A、B两个烧杯中分别盛有100mL3.0mol/L的盐酸和烧碱溶液,向两个烧杯中分别加入等质量的Al粉,在相同条件下产生气体的体积比A:B=2:5,则加入铝粉的质量为( )
| A. | 8.1g | B. | 6.75g | C. | 5.4g | D. | 2.7 g |
18.生命起源于海洋,科学家认为,由于海洋中Al3+的浓度极低,所以Al元素未成为人体内的必需元素,相反它对人体有害,下列有关铝的说法中不正确的是( )
| A. | 家庭不宜用铝锅长期盛放菜,汤等食品 | |
| B. | 明矾[KAl(SO4)2•12H2O]含结晶水,是混合物 | |
| C. | Al既能与盐酸反应,又能与NaOH溶液反应 | |
| D. | 铝热反应是放热反应 |
15.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若X原子的最外层电子数是次外层电子数的3倍,下列说法不正确的是( )
| X | |||
| Y | Z | W |
| A. | 原子半径:Y>Z>X | |
| B. | 气态氢化物的稳定性:W>Z>X | |
| C. | 最高价氧化物对应水化物的酸性:W>Z>Y | |
| D. | W的单质能与水反应,生成一种具有漂白性的物质 |
2.下列叙述正确的是( )
| A. | 某元素基态原最外层有3个未成对电子,最内层有2个电子,其元素符号为N | |
| B. | 某元素的负一价离子的电子层结构与氩相同,其基态原子价电子排布式为[Ne]3s23p5 | |
| C. | 某元素的正三价离子的3d能级为半充满,其基态原子排布式为[Ar]3d64s2 | |
| D. | 某元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的电子排布式为[Ar]3d54s1 |