题目内容
【题目】回答下列问题:
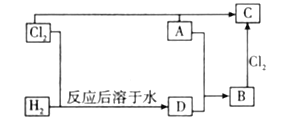
(1)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
![]()
在上述由SiCl4(g)制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___。
(2)利用水煤气合成二甲醚的总反应为:3CO(g)+3H2(g) = CH3OCH3(g)+CO2(g) ΔH=-246.4 kJ·mol-1,它可以分为两步,反应分别如下:2CO(g)+4H2(g) = CH3OCH3(g)+H2O(g) ΔH1=-205.1 kJ·mol-1,CO(g)+H2O(g) = CO2(g)+H2(g) ΔH2=_____。已知CH3OCH3(g)的燃烧热为1455 kJ·mol-1,写出表示其燃烧热的热化学方程式:__________。
(3)用O2将HCl转化为Cl2,可提高效益,减少污染。一定条件下测得反应过程中 c(Cl2)的数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
c(Cl2)/10-3 mol/L | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0 min内HCl的反应速率为_____。
(4)在一定温度下的定容容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥c(I2):c(H2):c(HI)=1:1:2,⑦氢气的百分含量。能说明I2(g)+H2(g) ![]() 2HI(g)达到平衡状态的是____。
2HI(g)达到平衡状态的是____。
(5)在恒温恒压、不做功时,反应A+B = C+D一定能自发进行的条件是ΔH__0且ΔS___0(填“<”、“>”或“=”)。
【答案】SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) H=+a/40 kJ·mol-1 -41.3 kJ·mol-1 CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) H=-1455 kJ/mol 1.8×10-3 mol/(L·min) ⑤⑦ < >
Si(s)+4HCl(g) H=+a/40 kJ·mol-1 -41.3 kJ·mol-1 CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) H=-1455 kJ/mol 1.8×10-3 mol/(L·min) ⑤⑦ < >
【解析】
(1) 1.12 kg纯硅的物质的量是1120 g÷28g/mol=40mol,所以生成1mol硅吸收a/40 kJ能量;
(2)根据盖斯定律计算ΔH2;CH3OCH3(g)的燃烧热是1mol CH3OCH3(g)完全燃烧生成二氧化碳和液态水放出的热量;
(3) O2将HCl转化为Cl2的方程式是O2+4HCl=2Cl2+ 2H2O,2.0~6.0 min内氯气浓度增大(5.4-1.8)×10-3 mol/L=3.6×10-3 mol/L,氯化氢浓度减小7.2×10-3 mol/L;
(4)根据平衡状态的标志判断;
(5) △H-T△S<0反应一定自发进行。
(1) 1.12 kg纯硅的物质的量是1120 g÷28g/mol=40mol,所以生成1mol硅吸收a/40 kJ能量,该反应的热化学方程式SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) H=+a/40 kJ·mol-1 ;
Si(s)+4HCl(g) H=+a/40 kJ·mol-1 ;
(2) ①3CO(g)+3H2(g) = CH3OCH3(g)+CO2(g) ΔH=-246.4 kJ·mol-1;
②2CO(g)+4H2(g) = CH3OCH3(g)+H2O(g) ΔH1=-205.1 kJ·mol-1;
根据盖斯定律①-②得 CO(g)+H2O(g) = CO2(g)+H2(g) ΔH2=-246.4 kJ·mol-1-(-205.1 kJ·mol-1)=-41.3 kJ·mol-1 。CH3OCH3(g)的燃烧热是1mol CH3OCH3(g)完全燃烧生成二氧化碳和液态水放出的热量,CH3OCH3(g)的燃烧热为1455 kJ·mol-1,表示其燃烧热的热化学方程式是CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) H=-1455 kJ/mol;
(3) 2.0~6.0 min内氯气浓度增大(5.4-1.8)×10-3 mol/L=3.6×10-3 mol/L,氯化氢浓度减小7.2×10-3 mol/L,HCl的反应速率为![]() 1.8×10-3 mol/(L·min) ;
1.8×10-3 mol/(L·min) ;
(4)①I2(g)+H2(g) ![]() 2HI(g)反应前后气体系数和相等,混合气体的压强是恒量,混合气体的压强不变不一定平衡,不选①;②I2(g)+H2(g)
2HI(g)反应前后气体系数和相等,混合气体的压强是恒量,混合气体的压强不变不一定平衡,不选①;②I2(g)+H2(g) ![]() 2HI(g)反应前后气体质量不变、容器体积不变,混合气体的密度是恒量,混合气体的密度不变不一定平衡,故不选②;③I2(g)+H2(g)
2HI(g)反应前后气体质量不变、容器体积不变,混合气体的密度是恒量,混合气体的密度不变不一定平衡,故不选②;③I2(g)+H2(g) ![]() 2HI(g)反应前后气体系数和相等,混合气体的总物质的量是恒量,混合气体的总物质的量不变不一定平衡,故不选③;④I2(g)+H2(g)
2HI(g)反应前后气体系数和相等,混合气体的总物质的量是恒量,混合气体的总物质的量不变不一定平衡,故不选③;④I2(g)+H2(g) ![]() 2HI(g)反应前后气体系数和相等,气体物质的量是恒量、气体质量是恒量,所以混合气体的平均相对分子质量是恒量,平均相对分子质量不变不一定平衡,故不选④;⑤I2(g)有颜色,混合气体的颜色不变,说明I2(g)浓度不变,一定达到平衡状态,故选⑤;⑥c(I2):c(H2):c(HI)=1:1:2,浓度比等于系数比不一定平衡,故不选⑥;⑦氢气的百分含量不变,说明氢气浓度不变,一定达到平衡状态,故选⑦。
2HI(g)反应前后气体系数和相等,气体物质的量是恒量、气体质量是恒量,所以混合气体的平均相对分子质量是恒量,平均相对分子质量不变不一定平衡,故不选④;⑤I2(g)有颜色,混合气体的颜色不变,说明I2(g)浓度不变,一定达到平衡状态,故选⑤;⑥c(I2):c(H2):c(HI)=1:1:2,浓度比等于系数比不一定平衡,故不选⑥;⑦氢气的百分含量不变,说明氢气浓度不变,一定达到平衡状态,故选⑦。
(5)根据△H-T△S<0反应一定自发进行,则A+B=C+D一定自发反应的条件是△H<0,△S>0。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。

(1)该反应的化学方程式为_____________,此反应平衡常数的表达式为K=________。
(2)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是________,该反应的△H________0。(填“![]() ”、“
”、“![]() ”或“=”)
”或“=”)
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的关系为_______(用“![]() ”、“
”、“![]() ”或“=”连接)。
”或“=”连接)。