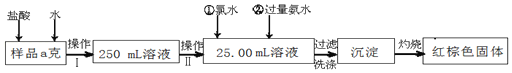
题目内容
【题目】含钒石煤(含有铁、硅、铝、钙、镁等元素的氧化物)中的钒大部分是以V(III)和V(IV)形式存在,由含矾石煤提钒的一种工艺流程如图所示:

已知:铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物。
回答下列问题:
(1)含矾石煤预制时加入复合添加剂对钒浸出率的影响如图所示,其中最佳复合添加剂为__,最佳添加比例为__。

(2)如图为“抽滤”实验原理装置图,"抽滤”时抽气泵的作用是__;“酸浸渣”经“水洗涤”返回“浸出”的目的是__。

(3)已知酸浸液中V2O24+被H2O2氧化成VO2+,其离子方程式为__。“净化除杂”时用铜铁试剂除去所含的Al3+、Fe3+等杂质离子而不通过调节酸浸液pH的原因是__。
(4)“沉钒”的离子反应方程式为___。
(5)“煅烧”纯净的沉钒产物过程中,固体残留率与温度变化如图所示。已知A点坐标为(260℃,85.47%)。则A点对应物质的化学式为__,B点对应的物质为V2O5,则B点坐标为___。

【答案】Na2CO3/K2CO3 1:1 抽走装置中的空气,形成负压,加快过滤速率 提高钒浸出率 ![]() 若调节酸浸液pH易生成Fe(OH)3、Al(OH)3胶体,胶体会吸附溶液中的钒酸根离子,造成钒损失
若调节酸浸液pH易生成Fe(OH)3、Al(OH)3胶体,胶体会吸附溶液中的钒酸根离子,造成钒损失 ![]() HVO3 (400℃,77.78%)
HVO3 (400℃,77.78%)
【解析】
(1)读图找出最佳复合添加剂及最佳添加比例;
(2)从从抽滤的原理来回答作用;“酸浸渣”经“水洗涤”返回“浸出”的目的从提高原料利用率的角度回答;
(3)结合氧化还原反应的规律写离子方程式,“净化除杂”时用铜铁试剂除去所含的Al3+、Fe3+等杂质离子而不通过调节酸浸液pH的原因,从二种方法的优劣比较来回答;
(4)读图找到产生沉淀的反应物,据此写“沉钒”的离子反应方程式;
(5)读图,结合质量守恒定律中元素质量守恒计算和化学反应规律回答。
(1)据图可知,Na2CO3/K2CO3作复合添加剂时,钒浸出率最高,添加比例为1:1;
故答案为:Na2CO3/K2CO3;1:1;
(2)"抽滤"比过滤效果好速度快的原因是装置内外压强差大,是利用抽气泵使吸滤瓶中的压强降低,使过滤速度加快;
答案为:抽走装置中的空气,形成负压,加快过滤速率;
“酸浸渣”经“水洗涤”返回“浸出"可提高钒元素的浸出率;
答案为:提高钒浸出率;
(3) V2O24+被H2O2氧化成VO2+,H2O2作氧化剂,其还原产物为水,则离子方程式为:![]() ;
;
答案为:![]() ;
;
按信息,铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物而除去,若调节酸浸液pH易生成Fe(OH)3、Al(OH)3胶体,胶体会吸附溶液中的钒酸根离子,造成钒损失;
答案为:若调节酸浸液pH易生成Fe(OH)3、Al(OH)3胶体,胶体会吸附溶液中的钒酸根离子,造成钒损失;
(4)据流程图知,“含钒净化液”中的![]() 与铵盐中
与铵盐中![]() 结合生成
结合生成![]() 沉淀;
沉淀;
答案为:![]() ;
;
(5) 260℃时若分解生成HVO3和NH3,则剩余固体质量与初始固体质量的百分比为![]() ×100%≈85.47%,所以A点(260℃ )对应物质的化学式为HVO3;
×100%≈85.47%,所以A点(260℃ )对应物质的化学式为HVO3;
答案为:HVO3;
B点对应的物质为V2O5 ,根据质量变化特点,可以得出剩余固体质量与初始固体质量的百分比为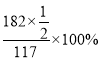 ≈77.78%,则B点坐标为(400℃,77.78%);
≈77.78%,则B点坐标为(400℃,77.78%);
答案为:(400℃,77.78%)。

【题目】回答下列问题:
(1)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
![]()
在上述由SiCl4(g)制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___。
(2)利用水煤气合成二甲醚的总反应为:3CO(g)+3H2(g) = CH3OCH3(g)+CO2(g) ΔH=-246.4 kJ·mol-1,它可以分为两步,反应分别如下:2CO(g)+4H2(g) = CH3OCH3(g)+H2O(g) ΔH1=-205.1 kJ·mol-1,CO(g)+H2O(g) = CO2(g)+H2(g) ΔH2=_____。已知CH3OCH3(g)的燃烧热为1455 kJ·mol-1,写出表示其燃烧热的热化学方程式:__________。
(3)用O2将HCl转化为Cl2,可提高效益,减少污染。一定条件下测得反应过程中 c(Cl2)的数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
c(Cl2)/10-3 mol/L | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0 min内HCl的反应速率为_____。
(4)在一定温度下的定容容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥c(I2):c(H2):c(HI)=1:1:2,⑦氢气的百分含量。能说明I2(g)+H2(g) ![]() 2HI(g)达到平衡状态的是____。
2HI(g)达到平衡状态的是____。
(5)在恒温恒压、不做功时,反应A+B = C+D一定能自发进行的条件是ΔH__0且ΔS___0(填“<”、“>”或“=”)。